Classificare i pazienti affetti da Neuropatia delle piccole fibre in base alla diversa sintomatologia è indispensabile, sia per capire e indirizzare più velocemente verso la patologia causale sottostante, sia per trattamenti personalizzati, adattati alle varie caratteristiche specifiche della patologia. Questo il pensiero del Dr. Todd Levine – Honor Health Neurology Department, Phoenix Neurological Associates, Phoenix, AZ, USA – esposto in un Suo articolo pubblicato nella Letteratura Scientifica Internazionale il 18 aprile 2018. Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
La Neuropatia delle Piccole Fibre può presentarsi in diverse forme, che possono essere classificate almeno in 4 clusters (raggruppamenti) dei sintomi, che determinano 4 relativi fenotipi clinici, qui riassunti in breve e dettagliati nella traduzione che segue:
- SFSCD (Small Fiber Sodium Channel Dysfunction, Disfunzione delle Piccole Fibre da Canale del Sodio), pazienti con disfunzione del canale del sodio
- SFMPN (Small Fiber–Mediated Painful Neuropathy, Neuropatia Dolorosa Piccole Fibre-Mediata), pazienti con sintomi neurologici classici
- SFMWP (Small Fiber–Mediated Widespread Pain, Dolore Diffuso Piccole Fibre-Mediato), pazienti con dolore neuropatico diffuso
- SFMAD (Small Fiber–Mediated Autonomic Dysfunction, Disfunzione Autonomica Piccole Fibre-Mediata), pazienti con sintomi autonomici
È possibile una forma esclusivamente somatica – con solo dolore – una disfunzione puramente autonomica, o in alcuni pazienti una combinazione di entrambe. Può comportare sintomi classici di dolore neuropatico o sintomi dolorosi più diffusi e che coinvolgono anche la parte muscolare.
Essere in grado di classificare ed analizzare i pazienti nei diversi sottogruppi di neuropatie consente una migliore comprensione della fisiopatologia, diagnosi più precise e un potenziale miglioramento delle condizioni del paziente: terapie più mirate ed efficaci. Le terapie devono essere valutate in base al gruppo di appartenenza, per evitare trattamenti inutili o addirittura dannosi.
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
La seguente traduzione è puramente a scopo divulgativo e non è in alcun modo a scopo di lucro. Qualsiasi utilizzo a scopo di lucro non è autorizzato. Il testo di seguito non sostituisce in alcun modo fonti mediche ufficiali, né il lavoro del medico. Rivolgersi sempre al proprio medico e fare sempre riferimento a testi e fonti originali.
Articolo originale online:
http://journals.sagepub.com/doi/full/10.1177/1179573518771703
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5912271/
Neuropatia delle Piccole Fibre: Classificazione della Malattia Oltre il Dolore e il Bruciore Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Titolo originale: Small Fiber Neuropathy: Disease Classification Beyond Pain and Burning Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Autore :Todd D Levine
Pubblicazione su: J Cent Nerv Syst Dis. 2018; 10: 1179573518771703.
Prima Pubblicazione: 18 Aprile 2018
doi: 10.1177/1179573518771703
Abstract Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
La Neuropatia delle Piccole Fibre (Small Fiber Neuropathy, SFN – in italiano per convenzione abbreviata NPF, qui riportata con la sigla originale inglese N.d.T) ha un processo patologico poco conosciuto, ma i pazienti trarrebbero beneficio dalla determinazione di fenotipi clinici che permettano una migliore diagnosi e pianificazione del trattamento. Propongo che i pazienti debbano essere classificati in base alla presenza o meno di disfunzione del canale del sodio, solo sintomi neurologici classici, dolore neuropatico diffuso o sintomi autonomici. I pazienti con SFN possono quindi essere considerati alla luce del loro fenotipo clinico, consentendo di concentrarsi su sottogruppi di pazienti che potrebbero avere condizioni diagnosticabili o essere più inclini a rispondere ad un particolare tipo di terapia che potrebbe non essere efficace nella popolazione più ampia di pazienti con SFN. Ci sono diverse terapie attualmente disponibili che possono affrontare i sintomi di SFN; tuttavia, per sviluppare nuove strategie terapeutiche, sarà imperativo classificare i pazienti per capire e orientare la patologia sottostante.
Introduzione Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Sin dal lavoro del XIX secolo di Ramón y Cajal e del neurologo francese Charcot, i neurologi si sono concentrati sulla localizzazione, con la convinzione di vecchia data che solo comprendendo se un processo patologico colpisce il cervello, il midollo spinale, i nervi e / o i muscoli, il clinico può iniziare a determinare la causa della patologia specifica. Nel sistema nervoso periferico, ora capiamo che alcune malattie possono colpire tutti i tipi di nervi, ma altre possono essere confinate solo alla mielina o solo all’assone. Allo stesso modo, una malattia può colpire solo neuroni di grandi fibre o neuroni delle fibre piccole. Anche all’interno di malattie che colpiscono unicamente le piccole fibre, ora capiamo che questo può presentarsi come una rottura esclusivamente sensoriale come il dolore, una disfunzione puramente autonomica, o in alcuni pazienti una combinazione di entrambi, sensoriale e autonomica. Essere in grado di analizzare pazienti in diversi sottogruppi di neuropatie consente una migliore comprensione della fisiopatologia e dei potenziali trattamenti. Una malattia che trarrebbe beneficio da una determinazione più specifica dei fenotipi clinici, per consentire una diagnosi più precisa e un potenziale miglioramento delle condizioni del paziente, è la Neuropatia delle Piccole Fibre (Small Fiber Neuropathy, SFN).
La Neuropatia delle Piccole Fibre è il risultato di danni ai nervi periferici, inclusi quelli che sono piccoli e mielinizzate (Aδ), così come quelli che non sono mielinizzate (fibre C amieliniche). Nelle SFN, possono essere coinvolte le piccole fibre somatiche e quelle autonomiche. Normalmente queste fibre controllano la percezione termica e del dolore e controllano le funzioni autonomiche ed enteriche. Per questo motivo, i pazienti con SFN possono presentare sintomi sia autonomici che somatici o entrambi. I sintomi sono potenzialmente numerosi e possono includere allodinia, bruciore, ridotta percezione termica, iperestesia, parestesia, intorpidimento degli arti inferiori che può potenzialmente colpire gli arti e il tronco, sindrome delle gambe senza riposo, secchezza degli occhi e della bocca, sudorazione anormale, problemi di controllo della vescica, problemi gastrici, decolorazione della pelle e sintomi cardiaci. I sintomi cardiaci includono sincope, palpitazioni e ipotensione ortostatica. Anche senza disfunzione autonomica diffusa, una percentuale di pazienti con Sindrome da Tachicardia Ortostatica Posturale (Postural Orthostatic Tachycardia Syndrome, POTS) può avere SFN.
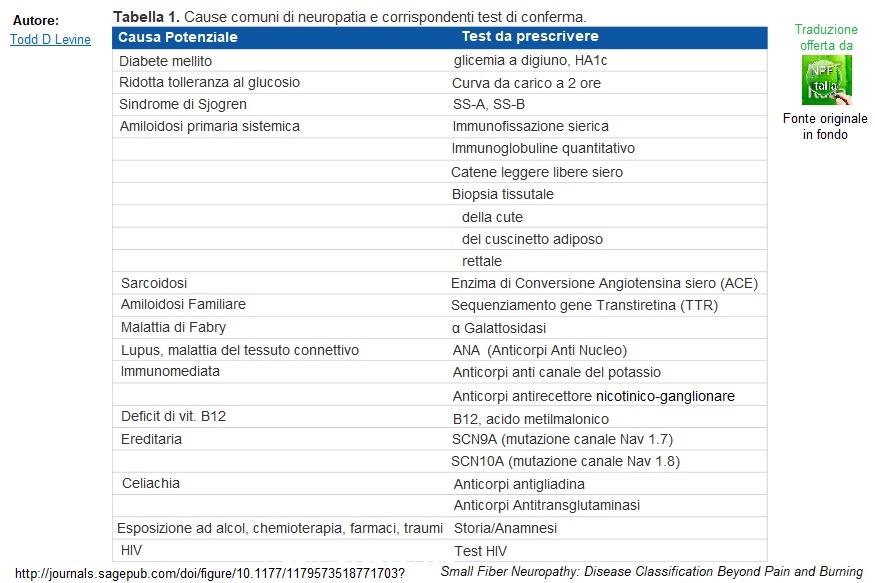
La Neuropatia delle Piccole Fibre ha un processo patologico poco conosciuto. Può essere il risultato di una varietà di malattie, tra cui diabete mellito, malattie autoimmuni quali Sjögren o sarcoidosi, paraproteinemia e sindrome paraneoplastica, con il diabete mellito che è la causa più comune di SFN (Tabella 1) di seguito tradotta. Anche la Polineuropatia Amiloide Ereditaria provoca danni alle piccole fibre nervose. Le neuropatie amiloidi possono essere multisistemiche o relegate al sistema cardiaco o solo neuropatie. Vi può essere una qualche presentazione di neuropatia e di sintomi cardiaci senza che sia diffusa. Le neuropatie amiloidi familiari includono quelle causate da mutazioni del gene TTR che codifica la proteina transtiretina, o il gene dell’apoliproteina A1 e quello della gelsolina.
Tabella 1. Cause comuni di neuropatia e corrispondenti test di conferma
Considerazioni per la diagnosi e il trattamento delle Neuropatie delle Piccole Fibre
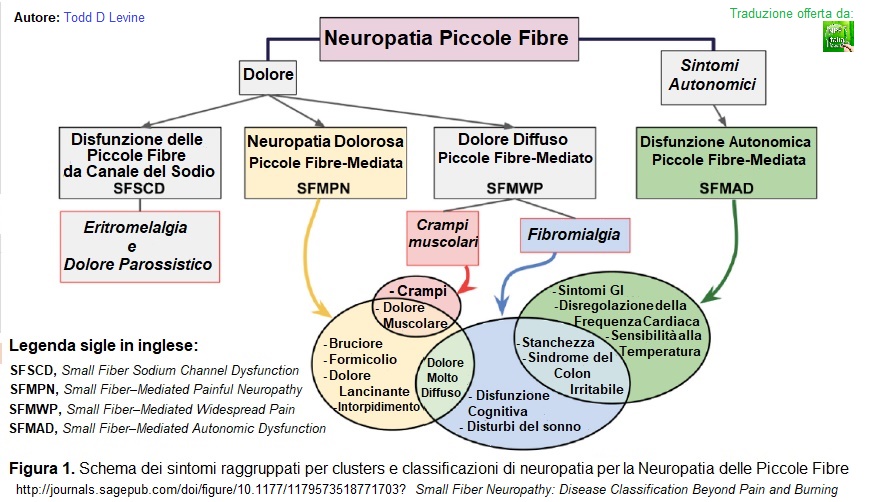
Come mostrato in Figura 1 (di seguito tradotta), i pazienti con SFN possono presentare un’ampia varietà di sintomi, sia somatici che autonomici. Sebbene a volte possa esserci una significativa sovrapposizione tra questi sintomi, i pazienti con SFN possono essere considerati in termini di fenotipi clinici, come un modo per concentrarsi su sottogruppi di pazienti più piccoli, che potrebbero avere condizioni diagnostabili o rispondere a specifici farmaci che non trattano tutti i pazienti con SFN. In tale ottica, suggerisco di usare il termine Disfunzione delle Piccole Fibre da Canale del Sodio (Small Fiber Sodium Channel Dysfunction, SFSCD) come un modo per riferirsi a pazienti che hanno sintomi di dolore parossistico neuropatico caratteristico di mutazioni nelle proteine del canale del sodio come NaV1.7, 1.8 o 1.9. Questi pazienti possono essere stati precedentemente etichettati come aventi eritromelalgia o altri disturbi del dolore parossistico. Questi pazienti possono differire da altri pazienti con SFN poiché possono avere mutazioni geneticamente provate nei loro canali del sodio e ipereccitabilità nervosa fisiologicamente dimostrata, senza avere una densità di fibre nervose intraepidermiche ridotta. Mentre gli attuali bloccanti del canale del sodio non sono sempre efficaci, i nuovi farmaci bloccanti i canali del sodio potrebbero essere rivoluzionari per questo sottogruppo di pazienti, sebbene non utili per i pazienti con altre cause di SFN dolorosa.
Figura 1. Schema dei sintomi raggruppati per cluster e classificazioni di neuropatia per la Neuropatia delle Piccole Fibre
Oltre ai pazienti con SFN canale del sodio-mediata, vi sono pazienti con SFN che presentano sintomi neuropatici classici come bruciore, formicolio, dolore lancinante e intorpidimento. Questi pazienti possono essere classificati nel gruppo Neuropatia Dolorosa Piccole Fibre-Mediata (Small Fiber–Mediated Painful Neuropathy, SFMPN). Questi pazienti avranno una ridotta densità delle fibre nervose intraepidermiche sulla biopsia cutanea oltre ai classici sintomi neuropatici. Un altro gruppo di pazienti che recentemente ha dimostrato di avere una prova oggettiva di danno alle piccole fibre sono pazienti che hanno dolore più diffuso, sperimentando crampi e dolori muscolari, e in molti casi, questi pazienti sono stati confusi con fibromialgia. Propongo di etichettare il gruppo di questi pazienti con evidenza di perdita oggettiva di piccole fibre nervose con Dolore Diffuso Piccole Fibre-Mediato (Small Fiber–Mediated Widespread Pain, SFMWP). Questi pazienti hanno spesso sintomi come mal di testa, stanchezza, sindrome dell’intestino irritabile, disfunzione cognitiva e disturbi del sonno. In una forma estrema di questi disturbi, i pazienti hanno evidenze oggettive per la disfunzione autonomica: studi dello svuotamento gastrico anormali, con nausea e vomito, anomalie del Tilt Test e del Test del Riflesso Autonomico Sudomotorio Quantitativo (Quantitative Sudomotor Autonomic Reflex Testing, QSART). Questi pazienti dovrebbero essere etichettati come aventi una Disfunzione Autonomica Piccole Fibre-Mediata (Small Fiber–Mediated Autonomic Dysfunction, SFMAD), poiché il loro fenotipo clinico è spesso sovrastato dai sintomi gastrointestinali, dalla disregolazione della frequenza cardiaca, dalla sensibilità alla temperatura, stanchezza e sindrome dell’intestino irritabile.
Dalla Figura 1 (sopra tradotta) si vede chiaramente che vi è una varietà di sintomi che si sovrappongono tra queste diverse categorie di SFNs. Questo sarebbe previsto dato che, in questi casi, la localizzazione della fisiopatologia è le piccole fibre nervose. I pazienti che soffrono di ipereccitabilità delle piccole fibre nella SFSCD (Disfunzione delle Piccole Fibre da Canale del Sodio) potrebbero però, non essere lo stesso tipo di pazienti che manifestano Disfunzione Autonomica Piccole Fibre-Mediata (SFMAD), pertanto potrebbe essere inappropriato avere un approccio al loro algoritmo diagnostico e al trattamento allo stesso modo.
Diagnosi
Per posizionare correttamente un paziente nelle sottocategorie di SFN, cioè SFSCD, SFMPN, SFMWP, SFMAD, è essenziale avere una cronologia completa di tutti i sintomi del paziente. I pazienti possono aver bisogno di biopsie cutanee, test dei riflessi autonomici, studi di svuotamento gastrico, ecc. per sapere quanti dei loro sintomi possono essere definiti obiettivamente. Una volta che a un paziente viene diagnosticata un Disordine Piccole Fibre –Mediato, è necessaria un’indagine approfondita per cercare potenziali cause della neuropatia. È importante notare che questo articolo esamina solo i pazienti con SFN pura, definiti con normali esami neurologici e normali studi sulla conduzione nervosa. La Tabella 1 elenca le cause comuni di neuropatia e i test corrispondenti per escludere tali cause. Una storia dettagliata del paziente dovrebbe essere presa in considerazione per determinare se esiste una storia familiare di neuropatie, fattori di rischio per il virus dell’immunodeficienza umana (HIV), infezione da epatite C, storia di esposizione a neurotossine e chemioterapici. Inoltre, devono essere eseguiti test di laboratorio tra cui la conta ematica (emocromo), enzimi metabolici, lipidi, velocità di sedimentazione degli eritrociti (VES), ormoni tiroidei, anticorpi antinucleari (ANA), livello di enzima di conversione dell’angiotensina (ACE), test di immunofissazione, vitamina B12 e un test di tolleranza al glucosio. In alcuni casi, possono essere necessari esami di laboratorio speciali a seconda della storia clinica specifica del paziente. Nei casi più gravi, la valutazione più aggressiva può includere la puntura lombare, il cuscinetto adiposo e le biopsie rettali, nonché le biopsie del nervo surale.
Trattamenti Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Nel caso di SFN che può essere attribuita ad una determinata causa sottostante, la causa sottostante dovrebbe essere gestita per modificare la SFN (ad esempio il controllo del glucosio, l’esercizio, per la SFN associata a disglicemia). La gestione del dolore ed altre terapie sintomatiche sono componenti cruciali del regime di trattamento per i pazienti con neuropatia, poiché il dolore può essere migliorato fino al 50%, sebbene l’eliminazione del dolore non venga solitamente raggiunta. Esistono prove limitate per terapie specifiche nel trattamento delle sindromi da dolore neuropatico; tuttavia, ci sono alcune opzioni di trattamento che possono essere efficaci nel trattare una varietà di tipi di SFN.
Due terapie raccomandate per il dolore neuropatico includono antidepressivi triciclici (TriCyclic Antidepressants, TCAs) e inibitori del reuptake della serotonina-noradrenalina (Serotonin-Norepinephrine Reuptake Inhibitors, SNRI). Gli antidepressivi triciclici hanno un elevato livello di evidenze che supportano il loro uso nel trattamento della neuropatia. Sono stati suggeriti essere una terapia di prima linea per il trattamento del dolore neuropatico cronico. L’uso di questi farmaci richiede potenzialmente un processo di aumento progressivo della dose e di e un tempismo appropriato della dose, per mitigare gli effetti collaterali sedativi o stimolanti. In genere, le dosi utilizzate per i pazienti con dolore neuropatico cronico sono inferiori a quelle utilizzate per esercitare effetti antidepressivi. Gli inibitori del reuptake della serotonina e norepinefrina sono anche usati per ridurre il dolore associato alla neuropatia; la loro efficacia deriva dalla loro capacità di potenziare percorsi inibitori nocicettivi. Il dosaggio degli SNRI per essere efficace nel ridurre il dolore è in genere più elevato rispetto alle dosi utilizzate per scopi antidepressivi. Sebbene questa classe di farmaci possa essere efficace per la riduzione del dolore, il profilo degli effetti indesiderati associato agli antidepressivi può limitare la loro utilità in alcuni pazienti e/o prevenire un appropriato aumento della dose.
Anche i farmaci anticonvulsivanti sono frequentemente utilizzati in pazienti con dolore neuropatico. Il gabapentin blocca il flusso di calcio attraverso i canali del calcio nel sistema nervoso centrale, mentre il pregabalin riduce l’afflusso di calcio nei neuroni periferici e centrali. Entrambi analoghi dell’acido γ-aminobutirrico sono considerati terapie di prima linea.
Recentemente, l’uso di oppiacei è diventato controverso. I Centri per il controllo e la prevenzione delle malattie, nonché la Food and Drug Administration, hanno emanato Linee Guida sull’uso degli oppiacei nel tentativo di combattere il crescente problema di salute pubblica sull’abuso e l’uso improprio di oppiacei. Tuttavia, è possibile utilizzare oppiacei, che tipicamente colpiscono il recettore μ-oppioide, per migliorare il dolore associato alla neuropatia, sebbene l’uso di oppiacei in soggetti con SFMAD (Disfunzione Autonomica Piccole Fibre-Mediata) possa essere problematico, in quanto gli oppiacei esogeni colpiscono il sistema nervoso enterico e peggiorano la funzione gastrointestinale. Poiché gli oppioidi possono essere abusati e usati in modo improprio e potrebbero non essere efficaci nei pazienti con SFN è imperativo sviluppare nuove terapie che mirino più specificamente alla fisiopatologia delle SFN. Attualmente, gli oppiacei dovrebbero essere considerati un’opzione di trattamento solo nei pazienti che hanno resistenza ad altri meccanismi di trattamento non-oppiacei e ci sono Linee Guida molto specifiche su come usare questi farmaci. Inoltre, i farmaci correlati, come gli inibitori del reuptake della norepinefrina, agonista del recettore μ-oppioide, agiscono non solo sul recettore μ-oppioide, ma agiscono anche per prevenire la ricaptazione della noradrenalina.
Anche i trattamenti topici possono essere usati per alleviare il dolore. I cerotti che contengono farmaci come la lidocaina possono agire localmente per inibire i canali del sodio e quindi la conduzione nervosa. Possono anche essere usati cerotti di capsaicina; tuttavia, la capsaicina colpisce il recettore vanilloide TRPV1; porta al deterioramento delle fibre nervose della pelle che possono rigenerarsi entro 3 mesi, fornendo quindi un sollievo temporaneo. Entrambi i cerotti possono essere usati da soli o in combinazione con altre terapie. Nuovi trattamenti in studio includono il targeting dei canali del potenziale transitorio del recettore, l’antagonista del Recettore dell’Angiotensina II Tipo 2 (Angiotensin II Type 2 Receptor, ATR2), il rilascio intratecale di farmaci per ridurre l’esposizione sistemica e l’uso di eritropoietina (EPO).
Nel caso di SFN immuno-mediate, vi sono diversi approcci al trattamento che hanno dimostrato un’efficacia preliminare. Uno studio retrospettivo su pazienti con SFN associata a sarcoidosi ha dimostrato che l’uso di immunoglobulina G per via endovenosa, il fattore di necrosi antitumorale o una loro combinazione, hanno portato a un miglioramento dei sintomi. Esiste attualmente una sperimentazione clinica che esplora l’utilità dell’IVIg (IntraVenous Immunoglobulin) in pazienti con SFN idiopatica (clinicaltrials.gov : NCT02637700). ARA 290 è una piccola molecola in via di sviluppo per approcciare la SFN correlata alla sarcoidosi ed ha avuto precoci risultati positivi. È un piccolo peptide derivato dall’EPO che si rivolge al complesso del recettore di riparazione innato. Dati preclinici indicano che ARA 290 è in grado di supportare la crescita delle fibre nervose intraepidermiche, e rapporti clinici preliminari indicano che può indurre piccole crescite di fibre nervose e fornire sollievo dai sintomi della neuropatia.
Le polineuropatie amiloidi ereditate possono essere trattate; tuttavia, i trattamenti possono variare dai farmaci convenzionali per neuropatia fino all’intervento chirurgico. Ad esempio, un trattamento di prima linea per individui con Polineuropatia Amiloide Familiare (Familial Amyloid Polyneuropathy, FAP) dovuta alla mutazione Val30Met, è il trapianto di fegato. La rimozione della fonte della proteina mutante e la sostituzione con una donazione di fegato consentono effettivamente una riduzione del 95% delle proteine varianti dal sangue e in definitiva hanno un impatto sulla progressione della malattia. Nei casi gravi, il trapianto di fegato può essere accompagnato da un trapianto di cuore a causa di cardiomiopatia. Nessuno di questi approcci, tuttavia, affronta la produzione di proteine amiloidi in altri tessuti come gli occhi o il sistema nervoso centrale. Sebbene il trapianto sia un trattamento accettato per la FAP, i risultati per i pazienti sono stati scarsi.
Sono stati esplorati nuovi approcci per affrontare la proteina mutata. Una di queste tattiche è l’uso di tafamidis. È in grado di legarsi selettivamente al TTR per stabilizzare e prevenire la dissociazione e l’aggregazione nei depositi di amiloide. Tafamidis è tipicamente indicato per l’uso in TTR-FAP sintomatico con depositi amiloidi accertati. Negli studi clinici, è stato dimostrato che riduce il peggioramento della funzione nervosa. Diflunisal è un farmaco antinfiammatorio non steroideo (NonSteroidal Anti-Inflammatory Drug, NSAID) che può anche legarsi al TTR e stabilizzare il tetramero. Uno studio di fase 1 inizialmente indicava che il FANS generico era in grado di stabilizzare il TTR circolante, riducendo il substrato disponibile per la formazione di amiloide. Uno studio di 2 anni sull’uso di diflunisal in pazienti con questa malattia ha dimostrato che può inibire la progressione della malattia. Un regime di doxiciclina e acido tauroursodeossicolico è stato analizzato in uno studio di fase 2 che indicava che la combinazione può stabilizzare la malattia.
Un altro approccio per ridurre la capacità di formazione dell’amiloide del TTR mutato è quello di prevenire la sua produzione in primo luogo. Brevi oligonucleotidi sintetici (ASO) diretti contro RNA messaggero TTR sono stati esplorati come metodo di riduzione delle proteine. Gli attuali dati clinici riguardanti l’uso di ASO provengono principalmente da volontari sani, ma sono in corso studi per valutare la capacità degli ASO di controllare la progressione della malattia. RNA di piccola interferenza (RNAi) sono stati portati a studi di fase 2, progettati come una nanoparticella lipidica che fornisce RNAi diretto contro una regione non tradotta 3 ‘di TTR mutante e di tipo selvaggio. Una singola dose di ALN-TTR02 ha ridotto la produzione di TTR; i dati di fase 2 indicano che la dose di ALN-TTR02 riduce in modo dipendente la proteina TTR circolante. Sono stati prodotti anticorpi monoclonali progettati per colpire la componente P amiloide sierica, sebbene questo sia un componente comune dei depositi di amiloide, non esclusivo del TTR. Ci sono attualmente studi clinici in corso con gli anticorpi impoverimento dell’amiloide; uno studio di fase 1 è stato avviato in pazienti con amiloidosi sistemica per determinare l’efficacia nella clearance dell’amiloide sierica. Attualmente non è chiaro se ciò influirà sulla progressione della malattia nei pazienti con amiloidosi TTR o porterà a una migliore funzionalità nervosa.
Conclusioni Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Per migliorare i risultati dei pazienti per coloro che hanno una disfunzione delle piccole fibre nervose e delle fibre nervose autonome, è indispensabile essere in grado di analizzarli in sottogruppi diversi. Abbiamo proposto e argomentato che i pazienti dovrebbero essere classificati come segue:
- SFSCD (Small Fiber Sodium Channel Dysfunction, Disfunzione delle Piccole Fibre da Canale del Sodio), pazienti con disfunzione del canale del sodio
- Pazienti con densità nervosa normale, ma anomalie note nei loro canali del sodio voltaggio-dipendenti che causano disfunzione nocicettiva, senza perdita di densità delle fibre nervose intraepidermiche.
- SFMPN (Small Fiber–Mediated Painful Neuropathy, Neuropatia Dolorosa Piccole Fibre-Mediata), pazienti con sintomi neurologici classici
- Pazienti con Elettromiografia (EMG)/Velocità di Conduzione Nervosa (Nerve Conduction Velocity, NCV) ed esami neurologici nella norma, che hanno ridotta densità delle fibre nervose intraepidermiche e il dolore neuropatico come disturbo predominante.
- SFMWP (Small Fiber–Mediated Widespread Pain, Dolore Diffuso Piccole Fibre-Mediato), pazienti con dolore neuropatico diffuso
- Pazienti con EMG/NCV ed esami neurologici nella norma che hanno ridotta densità delle fibre nervose intraepidermiche e dolore muscolare, dolore lancinante in contrasto con il dolore neuropatico come disturbo predominante.
- SFMAD (Small Fiber–Mediated Autonomic Dysfunction, Disfunzione Autonomica Piccole Fibre-Mediata), pazienti con sintomi autonomici
- Pazienti che hanno una disfunzione autonomica come disturbo predominante, ad es. POTS, instabilità autonomica e gastroparesi.
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
I pazienti dovrebbero essere classificati in base al tipo di SFN che sperimentano, per migliorare la gestione della malattia e i risultati dei pazienti. La distinzione tra i pazienti che hanno una disfunzione autonomica, in aggiunta alla neuropatia dolorosa indotta dalla disfunzione delle piccole fibre, è fondamentale per il corretto trattamento e la gestione della malattia. Ad esempio, gli individui con diagnosi di SFMPN (Neuropatia Dolorosa Piccole Fibre-Mediata, con sintomi neurologici classici) possono probabilmente rispondere agli anticonvulsivanti e ai farmaci che bloccano i canali, mentre quelli con SFMWP (Dolore Diffuso Piccole Fibre-Mediato, dolore neuropatico diffuso) potrebbero essere più propensi a rispondere ai TCA (antidepressivi triciclici) e agli SNRI (inibitori del reuptake della serotonina-noradrenalina). Fino a quando i pazienti non saranno classificati nei gruppi appropriati e gli algoritmi di trattamento adattati alle varie caratteristiche della patologia, non sarà possibile affrontare le questioni relative alla mancanza di efficacia di alcune terapie in soggetti con SFN.
Non solo la gestione del paziente è influenzata dalla classificazione appropriata della malattia di un paziente, ma anche il lavoro futuro per sviluppare nuove terapie e approcci possono essere ostacolati se le cause alla radice di ogni malattia non sono scoperte. La ricerca di nuove strategie ed agenti terapeutici può derivare dal raggruppare i pazienti insieme in modo più appropriato e studiando le somiglianze e le differenze e gli effetti sistemici sperimentati. Infine, classificare i pazienti più precisamente in base alla sintomatologia presentata, può portare alla comprensione del meccanismo sottostante lo sviluppo della neuropatia, in particolare nel determinare ciò che provoca neuropatia diffusa rispetto alla neuropatia amiloide che colpisce principalmente sistemi particolari.
Ringraziamenti
L’autore gradirebbe riconoscere l’assistenza alla scrittura medica fornita da AXON Communications.
Finanziamento:
l’autore (i) non ha ricevuto alcun sostegno finanziario per la ricerca, la paternità e / o la pubblicazione di questo articolo.
Dichiarazione di interessi contrastanti:
l’autore / i non ha dichiarato alcun potenziale conflitto di interesse rispetto alla ricerca, paternità e / o pubblicazione di questo articolo.
Note della Redazione, Ringraziamenti, Citazioni delle Fonti: Questo articolo – in ogni sua parte, inclusa traduzione – è puramente a scopo divulgativo e non è in alcun modo a scopo di lucro, ma pur sempre proprietà intellettuale degli anonimi Autori. Non sostituisce in alcun modo fonti mediche ufficiali, né il lavoro del medico. Rivolgersi sempre al proprio medico e fare sempre riferimento a testi e fonti originali. Non si risponde di alcun utilizzo improprio. Qualsiasi utilizzo a scopo di lucro non è autorizzato. Per la diffusione di questo materiale si raccomanda la citazione della Fonte mediante utilizzo del link al presente articolo e dei link delle Fonti originali. Fonte originale pubblicata sul PubMed e su SAGE. Si tratta di un articolo ad accesso libero, che consente l’uso, la distribuzione e la riproduzione illimitati su qualsiasi supporto, a condizione che l’opera originale sia citata correttamente.
Per citare questo articolo: https://neuropatiapiccolefibre.altervista.org/prima-classificazione-neuropatia-piccole-fibre-4-fenotipi-clinici-sintomi-per-migliore-gestione-paziente-differenti-cause-terapie/
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi
Neuropatia-Piccole-Fibre-4-Fenotipi-Clinici-Sintomi