L’Approccio Clinico alla Neuropatia delle Piccole Fibre (Small Fibre Neuropathy) e alle Canalopatie Dolorose
La seguente traduzione è puramente a scopo divulgativo e non è in alcun modo a scopo di lucro. Qualsiasi utilizzo a scopo di lucro non è autorizzato. Il testo di seguito non sostituisce in alcun modo fonti mediche ufficiali, né il lavoro del medico. Rivolgersi sempre al proprio medico e fare sempre riferimento a testi e fonti originali.
Articolo originale online: http://pn.bmj.com/content/early/2014/04/28/practneurol-2013-000758.full
Pract Neurol doi:10.1136/practneurol-2013-000758 Review The clinical approach to small fibre neuropathy and painful channelopathy
+ Author Affiliations
- 1Nuffield Department of Clinical Neurosciences, John Radcliffe Hospital, Oxford, Oxfordshire, UK
- 2Neuroscience Technologies, Parc Científic de Barcelona, Barcelona, Spain
- 3Department of Neurology, MC Mutual, Barcelona, Spain
Accepted 4 March 2014
Published Online First 28 April 2014
Abstract
La Neuropatia delle Piccole Fibre (NPF, Small Fibre Neuropathy, SFN) è caratterizzata da danni strutturali che colpiscono selettivamente gli assoni sensitivi. La presentazione clinica è dominata dal dolore. La SFN complica un numero di patologie comuni quali il diabete mellito ed è probabile che si incontri sempre di più. La diagnosi di SFN è impegnativa in quanto le caratteristiche cliniche possono essere vaghe e gli studi di conduzione del nervo possono essere normali. Nuove tecniche diagnostiche, in particolare la misurazione della densità delle fibre nervose intraepidermiche, hanno migliorato significativamente l’efficienza diagnostica della SFN. La gestione è focalizzata sul trattamento della causa sotttostante e sull’analgesia, poiché non esiste terapia neuroprotettiva. Un recente e significativo progresso è la scoperta che una percentuale di casi etichettati come SFN idiopatica (di origine ignota, N.d.T) è in realtà associata a mutazioni con acquisizione di funzione dei canali voltaggio-dipendenti del sodio Nav1.7 e Nav1.8 (codificati rispettivamente dai geni SCN9A e SCN10A). Vi è un ulteriore gruppo di condizioni dolorose ereditarie nelle quali mutazioni con acquisizione di funzione nei canali ionici alterano l’eccitabilità dei neuroni sensoriali ma non causano una franca degenerazione assonale; queste includono mutazioni in Nav1.7 (causando eritromelalgia e disturbo del dolore parossistico estremo) e TRPA1 (risultante nel disturbo del dolore episodico familiare). Queste condizioni sono eccezionalmente rare ma hanno fornito grandi intuizioni nel sistema nocicettivo nonché potenziali target farmacologici analgesici. In pazienti senza alcun fattore di rischio pre-esistente, l’indagine di una causa sottostante di SFN dovrebbe essere sistematica e appropriata per la popolazione di pazienti. In questa review, focalizziamo su come includere i recenti sviluppi nella diagnosi e fisiopatologia della SFN nella pratica clinica.
.Introduzione
La Neuropatia delle Piccole Fibre (NPF, Small Fibre Neuropathy SFN) è definita una anomalia strutturale delle piccole fibre caratterizzata patologicamente dalla degenerazione delle estremità finali delle terminazioni distali delle piccole fibre nervose (Figura 1). La SFN complica numerose patologie diffuse, quali il diabete mellito e l’HIV, e il dolore associato contribuisce significativamente alla morbilità di queste patologie. Mutazioni con acquisizione di funzione nei canali ionici voltaggio-dipendenti sono state recentemente mostrate provocare SFN3 ,4 e in aggiunta possono causare un numero di condizioni dolorose ereditabili nelle quali le piccole fibre sono ipereccitabili sebbene rimangano strutturalmente intatte. Questi disordini sono eccezionalmente rari ma hanno fornito grandi approfondimenti nel sistema nocicettivo, rivelando in alcuni casi importanti target per scoperte farmacologiche. Il neurologo clinico incontrerà SFN sempre piu di frequente, data la crescente prevalenza di diabete e i progressi nella diagnosi di SFN.5 Inoltre, vi è attualmente una maggiore chiarezza dei criteri diagnostici. In questa review, forniremo uno schema per diagnosticare e gestire queste condizioni.
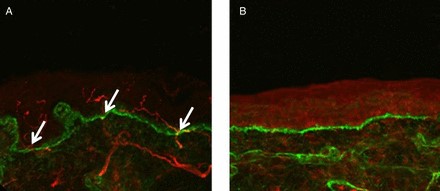
Figura 1
Immagini confocali di biopsie cutanee prelevate dalle gambe in un soggetto di controllo (A) e da un paziente con small fibre neuropathy secondaria a HIV (B) che mostrano le fibre immunoreattive al PGP 9.5 (rosso) e la membrane basale (etichettata con fibre di collagene tipo IV, verde). Le fibre nervose positive al PGP 9.5 (frecce bianche) vengono contate dove attraversano la giunzione dermo–epidermica. Le fibre nervose intra-epidermiche sono assenti nel paziente con HIV (B) consistente con la diagnosi di Neuropatia delle Piccole Fibre (Small Fibre Neuropathy). Scala bar: 50 µm.
Cosa sono le piccole fibre?
Le piccole fibre sono piccole fibre nervose dal diametro stretto mielinate (Aδ) e non-mielinate (C) del sistema nervoso periferico6 (figura 2). Le fibres somatosensoriali Aδ e C innervano il passaggio cutaneo attraverso il derma dove innervano le strutture cutanee; entrambi I gruppi di fibre terminano come terminazioni nervose libere nell’epidermide (le fibre Aδ perdono la loro guaina mieinica dove attraversano la giunzione dermo-epidermica). Le fibre Aδ sono responsabli della trasmissione dell’input freddo e di quello nocicettivo. Le fibre C trasmettono innocue sensazioni calde e sensazioni fredde possibilmente innocue,7 e input nocivi da una varietà di stimoli a soglia elevata meccanici, termici e chimici. Le piccole fibre rivestono un ruolo importante nel sistema nervoso autonomico, poiché le sottili fibre mielinate contribuiscono alle fibre preganglioniche e le fibre C contribuiscono alle fibre postganglioniche,8 innervando strutture quali le ghiandole sudoripare, i vasi sanguigni e il cuore. Il fattore di crescita del nervo (Nerve growth factor, scoperto in una serie di esperimenti innovativi dal Premio Nobel Rita Levi-Montalcini9) è un fattore target-derivato chiave per questi neuroni. Mutazioni nel fattore di crescita del nervo o del suo recettore altamente affine NTRK1 determinano degenerazione dei nocicettori e neuroni del sistema nervoso simpatico; questo porta rispettivamente a neuropatia autonomica e sensitiva ereditaria tipo 5 e 4.10 La grave disabilità causata da danni non dolorosi illustra la vitale importanza del sistema nocicettivo.
Eziologia, epidemiologia e patogenesi
L’esatta incidenza e prevalenza della SFN è sconosciuta.1 ,11 ,12 Non ci sono stati studi soddisfacenti per stabilire l’epidemiologia della SFN, poiché fino ai tempi recenti, non vi era una definizione generalmente accettata per la SFN né alcuna classificazione standardizzata. Vi sono pochi studi dell’evoluzione, e il parere generale è che nella maggioranza dei pazienti non progrdisca o progredisca molto lentamente.5 ,12
Esistono molte potenziali cause di SFN (table 1),1 ,12 la più comune il diabete mellito, responsabile approssimativamente di un terzo di tutti i casi di SFN.5 Nel diabete mellito, un complesso interscambio di fattori metabolici, ischemia e alterato recupero predispone neuroni periferici, cellule gliali e cellule endoteliali vascolari a una danno che infine conduce a danno neuronale e neuropatia periferica.13–,15 Interessante come, in quei pazienti con SFN la cui diagnosi non è immediatamente apparente, un numero significativo abbia alterata tolleranza al glucosio sia al momento della presentazione che al follow-up successivo, generalmente dopo circa 1 anno.5 Tuttavia, la diagnosi di alterata tolleranza al glucosio può solamente riflettere la sottostante elevata incidenza dell’alterata tolleranza al glucosio nella popolazione studiata piuttosto che un collegamento causale. L’HIV e l’uso continuativo di antiretrovirali neurotossici sono probabilmente la principale causa di SFN nell’Africa sub-Sahariana.16 L’HIV causa danno assonale periferico mediante attivazione immunitaria che crea un microambiente tossico per i nervi periferici.17 Gli anti-retrovirali, nello specifico gli inibitori nucleoside reverse transcriptase quali didanosine e stavudine, causano danno assonale mediante tossicità mitocondriale.16 La SFN si verifica in numerose malattie autoimmuni e infiammatorie (Tabella 1). Gli esatti meccanismi fisiopatologici sono sconosciuti, e i meccanismi più accreditati includono autoanticorpi rivolti contro le proteine neuronali (la cui identità è ancora sconosciuta), elevate citokine pro-infiammatorie nella cute e vasculiti dermiche.1 La neuropatia Amiloide (sia ereditaria che acquisita) può presentarsi come una SFN pura e generalmente progredisce fino a coinvolgere le grandi fibre neuronali e organi maggiori, quali reni e cuore.18 ,19
Tabella 1
Cause di Neuropatia delle Piccole Fibre (Small Fibre Neuropathy)
| Primaria | Secondaria |
| Idiopatica
▸ Neuropatia piccole fibre idiopatica ▸ Sindrome della bocca urente |
Metabolica
▸ Alterata tolleranza al glucosio ▸ Diabete mellito ▸ Rapido controllo glicemico ▸ Deficit di Vitamina B12 ▸ Dislipidemia ▸ Ipotiroidismo ▸ Malattia renale cronica |
| Ereditaria/genetica
▸ mutazioni Nav1.7 ▸ mutazioni Nav1.8 ▸ Polineuropatia Amiloide Familiare ▸ Malattia di Fabry ▸ Malattia di Tangier |
Infezioni
▸ HIV ▸ Epatite C ▸ Influenza |
| Tossine e farmaci
▸ Anti-retrovirali ▸ Antibiotici—metronidazolo, nitrofurantoin, linezolid ▸ Chemioterapia—bortezomib ▸ Flecainide ▸ Statina ▸ Alcohol ▸ Tossicità Vitamina B6 |
|
| Immuno mediata
▸ Celiachia ▸ Sarcoidosi ▸ Sjögren’s ▸ Artrite Reumatoide ▸ Lupus Eritematoso Sistemico ▸ Vasculite ▸ Malattia Infiammatoria Intestinale (IBD) ▸ Paraneoplastica ▸ Gammopatia monoclonale/amiloide |
Notare che alcune di queste conditioni può presentarsi come neuropatia delle piccole fibre ed evolvere fino a includere le grandi fibre.
La SFN si presenta in un numero di condizioni genetiche rare (Tabella 1). Un recente studio ha descritto varianti del gene SCN9A, che codifica il canale del sodio Nav1.7, in un terzo dei pazienti etichettati con diagnosi di SFN idiopatica.20 Questo canale ionio voltaggio-dipendente è espresso selettivamente in neuroni sensitivi ed autonomici.21 Varianti del Nav1.7 associate a SFN causano aumentata eccitabilità dei neuroni sensoriali e possibile degenerazione delle piccole fibre, che probabilmente è mediata da aumentato carico di sodio e scambio invertito di sodio–calcio.22 Il Nav1.8 è un canale correlato del sodio voltaggio-mediato espresso selettivamente nei nocicettori. Varianti nel gene SCN10A, che codifica il canale del sodio Nav1.8, innalzano l’eccitabilità delle cellule ganglionali della radice dorsale23 e sono anche associate a SFN. La penetranza di queste varianti dei canali del sodio voltaggio-dipendenti non è stata ancora pienamente chiarita e in alcuni casi queste varianti possono essere importanti fattori di rischio, piuttosto che essere pienamente penetranti nel provocare SFN. Questo rende attualmente complessa la consulenza genetica. La SFN idiopatica è stata storicamente attribuita al 23–94% dei casi.24 Nella nostra esperienza, approssimativamente il 50% dei casi di SFN è idiopatico. Tuttavia, questo dipende fortemente dai pattern di riferimento, e il numero di casi idiopatici si ridurrà se le cause genetiche sono identificate.
Presentazione Clinica
I sintomi di SFN variano tra pazienti sia per gravità che per progressione.1 ,5 Tipicamente i sintomi sensoriali iniziano nei piedi e progrediscono prossimalmente in modo lunghezza-dipendente, talvolta coinvolgendo le mani, un quadro tipo a guanto e calza. Il dolore è praticamente sempre il sintomo di presentazione e può essere estremamente grave e debilitante. Il dolore solitamente è continuo (ie, independente da stimoli), sebbene alcuni pazienti lamentino dolore evocato, per esempio, alcuni non tollerano che le lenzuola tocchino I piedi o indossare calzini. Il dolore è più spesso descritto come bruciore o pungente e può avere una componente di prurito. Attacchi di dolore scatenati da temperature aumentate o da esercizio possono indicare canalopatie dolorose (mutazioni Nav 1.7) e malattia di Fabry. A causa della mancanza di segni neurologici evidenti, i pazienti possono aver consultato molteplici specialisti e aver avuto numerose diagnosi, incluso ‘fascite plantare’ o ‘archi plantari collassati’, in alcuni casi portando a chirurgia non necessaria (che aggrava il dolore). A domanda diretta, i pazienti possono commentare su un’alterata sensibilità alle temperature, per esempio non essere in grado di sentire la temperatura dell’acqua della vasca da bagno con i piedi. Occasionalmente, la SFN segue uno schema non-lunghezza-dipendente con una perdita di funzione a chiazze coinvolgente aree focali quali il tronco o il viso, particolarmente nelle situazioni dovute a cause autoimmuni e infiammatorie. È importante indagare in merito alle disfunzioni del sistema nervoso autonomico, che possono includere ipotensione posturale, disfunzioni gastrointestinali o sessuali. Ipotensione posturale sintomatica dovrebbe sempre indurre a considerare la neuropatia amiloide.
All’esame clinico, possono esserci cambiamenti trofici quali pelle secca, screpolata o lucida sulle zone colpite. Tipicamente (e attenendosi rigorosamente ai criteri diagnostici di SFN) la funzione motoria, i riflessi tendinei profondi e la coordinazione sono normali, cosi come la funzione sensoriale delle fibre grandi, quali il tocco lieve, la sensazione vibratoria e la propriocezione. C’è spesso una perdita distale della sensazione termica o della puntura di spillo, e possono essere presenti anche iperalgesia e allodinia evocata da sfregamento, ma sono rare. A un esame sistemico, un calo posturale della pressione con tachicardia a riposo suggeriscono coinvolgimento del sistema nervoso autonomo. Possono esservi indizi dell’eziologia sottostante, quali l’angiocheratoma peri-ombeilicale e con distribuzione a calzoncino nella malattia di Fabry, caratteristiche tonsille ingrossate nella malattia di Tangier e linfadenopatia, organomegalia e nervi ispessiti associati ad amiloidosi.
Criteri Diagnostici per SFN
I criteri diagnostici di SFN nel diabete mellito sono stati recentemente rivisti e uno specifico pannello di esperienza clinica ha prodotto un set di criteri che enfatizzano fortemente le caratteristiche cliniche della SFN con associate indagini speciali. I criteri diagnostici sono i seguenti25:
- Possibile—sintomi e/o segni clinici lunghezza-dipendenti (perdita e/o allodinia/iperalgesia sensoriale alla puntura di spillo e termica).
- Probabile— sintomi lunghezza-dipendenti, segni clinici di danno delle piccole fibre e studi della conduzione del nervo normali.
- Certa— sintomi lunghezza-dipendenti, segni clinici di danno delle piccole fibre, studi della conduzione del nervo normali, e alterata densità intra-epidermica delle fibre nervose alla caviglia e/o anormale test sensoriale quantitativo delle soglie termiche ai piedi.
Lauria et al12 raccomandano fortemente l’uso di questi criteri nella SFN dovuta a qualsiasi causa, indipendentemente se la neuropatia sia lunghezza-dipendente o meno. Al momento, la miglior base probatoria per la diagnosi di SFN è la combinazione di segni clinici di disfunzione delle piccole fibre e ridotta densità intra-epidermica (piuttosto che le soglie termiche alterate, che hanno una ridotta efficacia diagnostica rispetto alla valutazione clinica).
Studi elettrodiagnostici
Il maggior limite degli studi convenzionali di conduzione del nervo è che primariamente studiano solo le fibre mielinate grandi e non possono individuare alcun cambiamento nelle piccole fibre. Nella SFN pura, gli studi convenzionali di conduzione del nervo saranno normali e pertanto il loro obiettivo è di escludere una associata componente delle grandi fibre, con implicazioni per la diagnosi differenziale. Laser possono essere utilizzati per stimolare le fibre Aδ, e i Potenziali Corticali Evocati associati (Potenziali Evocati Laser, Laser-Evoked Potentials, LEP) consentono di interrogare la via somatosensoriale dalle terminazioni delle fibre Aδ nella cute fino alla corteccia cerebrale.26 La microneurografia () utilizza microelettrodi di registrazione posizionati all’interno dei fasci nervosi e la tecnica di “marcazione” consente di registrare simultaneamente dalle piccole fibre.27 Questa è una potente fonte di ricerca in quanto la funzionalità delle piccole fibre può essere direttamente determinata e con il progresso della tecnologia è probabile che sarà sempre più utilizzata nella pratica clinica.
Test Sensoriale Quantitativo (Quantitative Sensory Testing, QST)
Il QST è uno strumento di indagine psicofisica per studiare la funzione del sistema nervoso somatosensoriale umano.28 Una varietà di prove meccaniche e termiche, non-nocicettive e nocicettive, di intensità misurata forniscono una valutazione della funzione delle fibre Aβ, Aδ e C e i loro corrispondenti percorsi centrali. Nell’ambito della ricerca sul dolore, vi sono crescenti sforzi per collegare particolari quadri di disfunzione sensoriale —individuati mediante questionari sui sintomi e QST— a sottostanti meccanismi patogenici.29 Possono essere misurate numerose variabili, quali soglie di rilevamento, soglie del dolore e funzioni stimolo–risposta. Ad esempio, nel protocollo del network di ricerca tedesco sul dolore neuropatico (German Research Network on Neuropathic Pain) (DFNS) , 7 test sensoriali generano 13 parametri di funzione sensoriale.30 Un recente progresso è la generazione di ampi set di dati normativi di controlli stabiliti per età e per genere.30 Il QST è stato adottato da un numero di associazioni come parte della valutazione della neuropatia periferica e del dolore neuropatico.31 Nel valutare la SFN, il rilevamento termico e le soglie del dolore sono comunemente utilizzate. Tuttavia, numerosi fattori interferiscono nella riproducibilità delle misurazioni del QST, inclusa la preparazione sia dell’esaminatore che del paziente, il metodo di valutazione, la temperatura cutanea di base, le caratteristiche dello stimolo, il sito e il numero di siti stimolati e la durata degli intervalli tra i test.28 Vi è stato un crescente sforzo per standardizzare I protocolli del QST e la formazione al fine di ridurre la variabilità.30 ,32 Bisognerebbe notare che il QST non può differenziare tra cause periferiche e centrali di deficit sensoriale, le misurazioni possono essere confuse da scarsa concentrazione o un deficit cognitivo, e I valori cut-off sono necessari per evitare danni cutanei, rendendo gli end point estremi inaffidabili. Riassumendo, il QST è un potente strumento di ricerca soprattutto quando applicato alla popolazione in studio ma è inadeguato come valutazione isolata della SFN. Dovrebbe essere visto come complementare a una valutazione clinica completa e indagini più specifiche, che sono misure più obiettive di danno allo piccole fibre.
Biopsia Cutanea
La quantificazione della densità intraepidermica delle fibre nervose è il più importante progresso nella diagnostica della SFN dell’ultimo decennio,5 ,33 ed è probabilmente la tecnica più convalidata per diagnosticare la SFN. Un prelievo bioptico cutaneo (skin punch biopsy) di 3 mm di diametro può essere prelevato da qualsiasi parte del corpo, ma viene generalmente preso a 10 cm prossimalmente al malleolo laterale a scopi diagnostici nella SFN.34 Un sito bioptico aggiuntivo frequentemente utilizzato è la coscia prossimale, 20 cm sotto la cresta iliaca, che in combinazione con la biopsia distale (sopra il malleolo) può aiutare a differenziare tra una neuropatia e una neuronopatia.35
L’analisi morfometrica delle piccole fibre viene eseguita utilizzando immunoistochimica a campo luminoso o immunofluorescenza indiretta. L’immunoistochimica a campo luminoso è la tecnica più comunemente utilizzata per la diagnostica di routine. Il campione di cute viene colorato con un antigene chiamato PGP 9.5 che viene trovato in tutte le fibre nervose 38 ,39.(Figura 1). È importante che le misurazioni siano comparate agli standard internazionali. È anche possibile inviare campioni di cute a mezzo corriere da ospedali esterni a laboratori di neuropatologia centrali per l’analisi e non vi è ragione che questo non venga richiesto dal neurologo. Una riduzione della densità intraepidermica delle fibre nervose sotto il quinto centile relativo per valori fissati per età e genere è considerata diagnostica di SFN,40 e diminuzioni della densità intraepidermica delle fibre nervose sono state correlate a sintomi di neuropatia e anomalie a test sensoriali.35 La densità intraepidermica delle fibre nervose è stata misurata in un’ampia varietà di condizioni e mostra risultati consistenti, e in studi nei quali la SFN era clinicamente sospettata, questa valutazione ha avuto una sensibilità del 90%, specificità del 95%, valore predittivo positivo del 95% e valore predittivo negativo del 91% per la diagnosi di SFN.35 In aggiunta alla valutazione quantitativa della biopsia cutanea, vi sono valutazioni qualitative delle piccle fibre nervose, quali gonfiore assonale come marcatore di cambiamenti pre-degenerativi o debole colorazione del PGP 9.5, sebbene queste siano meno affidabili da un punto di vista diagnostico. La biopsia cutanea con misurazioni della densità intraepidermica delle fibre nervose è la modalità diagnostica di scelta per la SFN; la biopsia del nervo non viene più eseguita per una SFN pura.
La microscopia corneale confocale in vivo mostra le basi per valutare l’innervazione delle piccole fibre in modo non invasivo in quanto può misurare e valutare l’innervazione corneale.41 La cornea è innervata da fibre Aδ e C che originano dalla divisione oftalmica del nervo trigemino. È la più densamente innervata del corpo umano e offre una finestra unica di osservazione dell’innervazione delle piccole fibre, in quanto il tessuto corneale vivente può essere valutato a livello cellulare. La densità e tortuosità del fascio di fibra nervosa corneale è stata studiata maggiormente nei pazienti con diabete mellito, ma anche nella malattia di Fabry, di Charcot–Marie–Tooth, nella SFN idiopatica e nella neuropatia e lunghezza-dipendente e non. La densità del fascio di fibra nervosa corneale è inversamente correlata alla gravità della neuropatia; tuttavia, minori fasci di fibra nervosa, maggiore la gravità della neuropatia.
Test del sistema nervoso autonomico
La valutazione obiettiva del sistema nervoso autonomico non è di poco conto.1 Se vi è una sospetta disfunzione autonomica sulla base dei sintomi ed esame, raccomandiamo test del riflesso cardiovascolare, quale il protocollo di Ewing,25 ,42 come valutazione iniziale del sistema nervoso autonomico, con successivo riferimento a una valutazione piu estesa che includa test quali la risposta cutanea simpatica. Un ulteriore sviluppo è che le biopsie cutanee potrebbero essere utilizzate per valutare il sistema nervoso autonomico in quanto nuove tecniche sono state sviluppate per valutare l’innervazione delle ghiandole sudoripare e del muscolo erettore del pelo, e scoperti essere correlati a disfunzione autonomica. Tuttavia, abbiamo bisogno di maggiore ricerca prima che possa essere utilizzata nella pratica clinica di routine.1
Approccio diagnostico alla SFN
Nei pazienti nei quali sia sospettata una SFN, il primo passo è confermare la diagnosi seguendo I criteri diagnostici sotto elencati (figura 5). Nei pazienti con pre-esistente fattore di rischio quali il diabete mellituso o HIV, può non essere necessario indagare oltre, a meno che non vi sia un sospetto clinico di un fattore esacerbante. In pazienti senza fattore di rischio pre-esistente la ricerca di una causa sottostante dovrebbe essere sistematica ed appropriata per tutti i pazienti. Possibli cause di SFN necessitano di essere considerate e organizzate indagini appropriate (Tabella 2). Se non vi è alcuna causa sottostante, raccomandiamo lo screening per una mutazione SCN9A, particolarmente in pazienti con esordio dei sintomi prima dei 40 anni di età e storia familiare.
Gestione
La chiave per la gestione della SFN è identificare ogni possibile causa trattabile, in quanto non esistono trattamenti che possano prevenire o far regredire la SFN. Ad esempio, un appropriato controllo del diabete mellito può arrestare la sua progressione e vi sono stati isolati report di regressione della neuropatia dopo trapianto pancreatico.50 Terapia immuno modulante, come le gamma globuline per via endovenosa, può ridurre il dolore associato alla celiachia51 e Sjögren52; tuttavia, è necessaria maggiore ricerca per confermare l’efficacia della terapia immunomodulante. Nella malattia di Fabry, la sostituzione dell’α-galattosidasi A riduce il dolore neuropatico e può ristabilire le soglie del caldo e del freddo e il riflesso del sudore.53 L’Amiloidosi è un disordine multisistemico potenzialmente fatale; esistono trattamenti sia per la forma familiare (trapianto di fegato) che acquisita (chemioterapia) che puè arrestare la progressione e in alcuni casi migliorare la neuropatia periferica.18 Purtroppo, in alcune condizioni come l’HIV, la progressione della SFN non è alterata da efficace soppressione dell’HIV. È anche importante usare cautela nel prescrivere agenti potenzialmente neurotossici, come alcuni antibiotici, nei pazienti con sottostante SFN (table 1).
Purtroppo, non abbiamo terapie neuroprotettive per la SFN. Alcuni trial sono stati intrapresi per rigenerare le fibre nervose (in particolare nella neuropatia diabetica) mediante la somministrazione di fattori neuroprotettivi, quali il fattore di crescita del nervo.55 Questi trial hanno dimostrato mancanza di efficacia e in alcuni casi effetti collaterali dose-limitanti. Tuttavia, una volta che la causa sottostante viene gestita con successo, assume priorità il trattamento delle complicazioni. Il dolore e la disfunzione autonomica sono le principali complicazioni problematiche della SFN. Sono entrambe difficili da trattare e gli attuali trattamenti sono lontani dall’essere soddisfacenti.
Non ci sono linee guida per il dolore associato a SFN. Recentemente, linee guida condivise per il dolore neuropatico sono state adattate per il trattamento del dolore nella SFN.2 Linee guida condivise pragmatiche includono quelle dell’UK’s National Institute of Health e Care Excellence e Map of Medicine.56 Questo include solitamente un trattamento di prima linea con gabapentinoidi, gabapentin o pregabalin (che si legano a α2δ1 e alterano il passaggio dei canali voltaggio-mediati del calcio), antidepressivi triciclici (indicazione senza licenza) o inibitori del reuptake serotonina-norepinefrina (autorizzati per la neuropatia diabetica dolorosa). I farmaci devono essere introdotti in modo graduale e titolati per efficacia ed effetti collaterali.13 Uno dei problemi comuni è un’insufficiente titolazione della dose. C’è qualche prova nel combinare classi di farmaci per trattare il dolore neuropatico.57 ,58 Vi è attualmente un crescente utilizzo di terape per uso topico, quali cerotti di lidocaina 5%, che sono utili se il dolore è localizzato (ad es., principalmente ai palmi dei piedi). Il trattamento con capsaicina ad alte dosi (8%) in crema causa desensibilizzazione delle fibre nervose, e sebbene i primi trial abbiano mostrato una certa efficacia nella neuropatia dolorosa da HIV59 questo non si è verificato in tutti I trial60 e necessita di essere somministrato nel contesto di una clinica specialistica. Se il dolore è grave e il trattamento di prima linea non soddisfacente, è essenziale rivolgersi aun clinica del dolore multidisciplinare per assicurare un trattamento globale al paziente. Integrazioni quali la valutazione psicologica e le strategie di gestione possono essere estremamente utili. La nostra politica è di valutare quei pazienti, nei quali il dolore non è adeguatamente controllato, in un approccio clinico al dolore congiunto insieme a terapisti del dolore con accesso a supporto psicologico. Trattare disfunzioni autonomiche è difficile, ma può rispondere a interventi specifici.61 È difficile stabilire con certezza la durata del follow-up per pazienti con SFN. È necessaria un indagine completa delle cause sottostanti e lo fisseremmo almeno a un anno per verificare la progressione. I pazienti necessitano di un follow-up a lungo termine per la gestione del dolore, che può essere fornito da una clinica del dolore.
Anche il trattamento delle canalopatie dolorose quali l’eritromelalgia è estremamente difficile.
Il Disturbo del Dolore Parossistico Estremo (Paroxysmal Extreme Pain Disorder, PEPD*) risponde alla carbamazepina; tuttavia, l’efficacia della carbamazepina nell’Eritromelalgia Ereditaria (Inherited Erythromelalgia, IE*) è meno predittibile. Può essere usata anche la mexiletina. La risposta alla terapia dipende dall’esatta mutazione; sia la carbamazepina che la mexiletina sono efficaci in termini di studi farmacologici in vitro e clinicamente. La predizione dell’efficacia potrebbe essere migliarata in futuro utilizzando modelli strutturali.62 Attualmente vi è un considerevole impulso a sviluppare bloccanti del Nav 1.7 più specifici e un certo numero di agenti farmacologici è attualmente in uso in trial clinici.
*argomenti tradotti nei prossimi articoli
Punti chiave
- La Neuropatia delle Piccole Fibre è definita una anomalia strutturale delle piccole fibre caratterizzata patologicamente da degenerazione delle terminazioni distali delle estremità delle piccole fibre nervose.
- Mutazioni con acquisizioni di funzione dei geni SCN9A o SCN10A che codificano i canali del sodio voltaggio-mediati Nav 1.7 e Nav 1.8 sono associate a Neuropatia delle Piccole Fibre precedentemente non spiegate.
- La diagnosi di Neuropatia delle Piccole Fibre è migliore eseguita mediante la combinazione di segni clinici di disfunzione delle piccole fibre e la valutazione della densità intraepidermica delle fibre nervose. La microscopia confocale corneale è un nuovo e promettente strumento di valutazione dell’integrità strutturale delle piccole fibre.
- La chiave per la gestione della Neuropatia delle Piccole Fibre è identificare ogni potenziale causa trattabile e focalizzare sulla gestione del dolore se possibile in un contesto multidisciplinare.
Ringraziamenti
We would like to acknowledge the support of the Wellcome Trust in the form of a strategic award to the London Pain Consortium and DLHB is a senior fellow in clinical science.
Note
Contributors ACT formulated the article, drafted the manuscript and revised it. JDR contributed figures 1, 2 and 4, and revised the manuscript. JS contributed figure 3 and revised the manuscript. DLHB formulated the article and reviewed the article for important intellectual content. All authors approved the final version of the manuscript.
Competing interests DLHB has consulted for and received honoraria from Astellas and Acorda Therapeutics and has received grant support from Pfizer in the form of a joint MRC CASE PhD studentship. DLHB is a member of the Innovative Medicines Initiative Europain collaboration, whose industry members are AstraZeneca, Pfizer, Esteve, UCB, Sanofi-Aventis, Grünenthal, Eli Lilly, Neuroscience Technologies and Boehringer Ingelheim. JS serves as consultant for Abbott, Astellas, Astra Zeneca, GSK, Johnson & Johnson, Sanofi and Shire. He has received financial support from the Innovative Medicines Initiative IMI JU, grant agreement 115007, and has stock from Neuroscience Technologies SLP.
Patient consent Obtained.
Provenance and peer review Commissioned; externally peer reviewed. Reviewed by Gareth Llewelyn, Cardiff.
This is an Open Access article distributed in accordance with the Creative Commons Attribution Non Commercial (CC BY-NC 3.0) license, which permits others to distribute, remix, adapt, build upon this work non-commercially, and license their derivative works on different terms, provided the original work is properly cited and the use is non-commercial. See: http://creativecommons.org/licenses/by-nc/3.0/
Bibliografia (vds articolo originale online: http://pn.bmj.com/content/early/2014/04/28/practneurol-2013-000758.full


i am from Italy hello. Can you help me translate? /rardor
hello everyone thanks for approve
Hey there, You’ve dne a great job. I will definitely digg it
and individually recommend to my friends. I am confident they’ll
be benefited from this site.