Sommario Neuropatia delle Piccole Fibre La Malattia:
Neuropatia delle Piccole Fibre: Descrizione Breve di una Malattia Complessa.
Sintomi AUTONOMICI o VEGETATIVI
SINTOMI IN ETA’ PEDIATRICA E ADOLESCENZA
ALTRE FORME E SINTOMI BAMBINI E ADULTI
LE SCOPERTE SCIENTIFICHE PIU RECENTI
NEUROPATIA DELLE PICCOLE FIBRE A ESORDIO PRECOCE
NEUROPATIA DELLE PICCOLE FIBRE IMMUNOMEDIATA
NEUROPATIA DELLE PICCOLE FIBRE IMMUNOMEDIATA DA AUTOANTICORPI ANTI TS‑HDS e FGFR-3
EHLER DANLOS SYNDROME E NEUROPATIA DELLE PICCOLE FIBRE
FIBROMIALGIA: LA NEUROPATIA DELLE PICCOLE FIBRE CAUSA IL 50% DEI CASI DI FIBROMIALGIA
LETTERATURA SCIENTIFICA MENO RECENTE
RIFERIMENTI OSPEDALIERI PER DIAGNOSI DI NEUROPATIA DELLE PICCOLE FIBRE MEDIANTE BIOPSIA CUTANEA
Neuropatia delle Piccole Fibre: Descrizione Breve di una Malattia Complessa.(1,2,3,4)
Descrizione, Sintomi, Diagnosi, Esami, Forme e Fenotipi Clinici, Trattamenti, Cause, Recenti Scoperte, Bambini e Adolescenti, Genetica Autoimmunità, Fibromialgia, Trial Clinici, Centri Ospedalieri
DESCRIZIONE (1-11)
La Neuropatia delle Piccole Fibre (in inglese Small-Fiber Neuropathy, SFN – in italiano abbreviata per convenzione NPF) è una malattia del Sistema Nervoso Periferico, che può manifestarsi a qualsiasi età. Riguarda danni diffusi che interessano prevalentemente gli assoni periferici di piccolo diametro non mielinizzati (fibre di C) o sottilmente mielinizzati (A-δ) che normalmente proteggono l’organismo segnalando il dolore al contatto dannoso. Nei pazienti affetti da questa Neuropatia, questi assoni danneggiati si attivano spontaneamente, anche in modo eccessivo e prolungato, anche in assenza di un reale contatto/stimolo doloroso in atto, provocando il cosiddetto dolore neuropatico (5,6).
Ha sintomi e tempi diversi da persona a persona. Ogni sintomo viene gestito da diversi specialisti. Tutti i sintomi sono in realtà riconducibili ad unica neuropatia non diagnosticata e non trattata.
La Neuropatia delle Piccole Fibre è secondaria ad altra patologia. Ogni caso clinico può avere una differente malattia causale sottostante (malattia primaria), non diagnosticata e non trattata. Quando non si conosce la causa, viene definita Neuropatia delle Piccole Fibre “Idiopatica” o “criptogenica”, che significa “di origine sconosciuta”. La forma definita “idiopatica” non può essere trattata a monte per la malattia causale primaria che la provoca.
Definita anche Polineuropatia delle Piccole Fibre (Small Fiber Polyneuropathy, SFPN)(7) è una polineuropatia che colpisce esclusivamente o preferenzialmente i piccoli assoni periferici non mielinizzati o sottilmente mielinizzati che servono alla nocicezione e alla funzione autonomica.
COSA SONO LE PICCOLE FIBRE E QUAL È LA LORO FUNZIONE (1, 8-11)
Le piccole fibre sono la tipologia più comune di cellule del Sistema Nervoso Periferico. La pelle è riccamente innervata dai piccoli assoni non mielinizzati (fibre C) e sottilmente mielinizzati (fibre A-delta) che trasmettono sensazioni difensive di dolore (nocicezione) e prurito.(11)
Includono differenti tipologie di cellule nervose:
- Le fibre C (non mielinizzate) trasportano le informazioni relative al dolore e alla temperatura. Rispondono tipicamente ad un tipo discreto di stimoli, come stimoli meccanici (un ago, una puntura, un taglio) o a temperature calde o fredde dannose e trasmettono in modo veloce questo tipo di dolore pungente, acuto e di breve durata dalla cute al SNC. La copertura sottile di mielina accelera la velocità di conduzione; di conseguenza, la natura soggettiva del dolore quando le fibre Aδ vengono stimolate viene spesso descritta come dolore immediato e ben localizzato. (11)
- Le fibre Delta A (Aδ) (scarsamente mielinizzate) portano informazioni relative a dolore, temperatura e prurito. Trasmettono più lentamente un dolore di tipo sordo, bruciante, causato da infiammazione, stimoli termici, chimici, meccanici persistenti e non ne consentono la localizzazione esatta. Questo tipo di dolore è più diffuso, fastidioso e intollerabile, più lento all’inizio e di lunga durata. Trasmettono inoltre al midollo spinale il dolore che deriva principalmente dai visceri e dalle strutture somatiche profonde.(11)
- Gli assoni autonomici collegano e gestiscono più organi e tessuti: pelle, vasi sanguigni, ghiandole sudoripare, intestino, ossa, cuore
Hanno molti compiti:
- Sensazioni difensive: dolore – prurito
- Funzioni autonomiche, trofiche, omeostatiche
- Combattono ferite e malattie; interagiscono con gli immunociti
Uno dei compiti chiave delle piccole fibre è di recepire il dolore. Se non stanno lavorando correttamente e bruciano senza una ragione la persona soffre di dolore neuropatico. (1,8)
Le funzioni autonomiche sono controllate dalle piccole fibre (9):
- Risposta della Frequenza Cardiaca alla Respirazione Profonda
- Risposta della Frequenza Cardiaca e della Pressione Arteriosa durante la Manovra di Valsalva
- Risposta della Frequenza Cardiaca e della Pressione Arteriosa al Tilt Test
- Risposta Sudomotoria
Sono coinvolte anche nel meccanismo di vasodilatazione e vasocostrizione, dai muscoli fino alla pelle: (10)
- Gli shunt arterovenosi (Aterovenous Shunt, AVS) spostano il flusso sanguigno dai capillari dei muscoli alla pelle per la regolazione del calore
- Le piccole fibre controllano se gli shunt sono chiusi o aperti
- Gli shunt dilatati possono causare dolore muscolare e intolleranza all’esercizio
- I muscoli possono non ricevere correttamente il nutrimento attraverso i vasi sanguigni
SINTOMI: (1,3,4,7,12-16)
I sintomi di Neuropatia delle Piccole Fibre/Polineuropatia delle Piccole Fibre talvolta appaiono con una distribuzione calza-guanto (piedi, mani), ma possono coinvolgere anche il volto, il tronco e persino l’intero corpo. Il dolore talvolta viene definito dolore “distale”, intendendo le estremità del corpo (mani, piedi). Ha però molti sintomi, non solo dolore ai piedi. La disfunzione delle piccole fibre causa anomalie autonomiche e sensoriali e i pazienti con SFPN riportano in genere sintomi misti sensoriali e autonomici (3,7)
La manifestazione clinica più comune è la sensazione di “piedi brucianti”, sebbene siano state descritte neuropatie focali – come la “notalgia” e la “bocca urente” – e una diffusione del dolore che suggeriscono il coinvolgimento dei neuroni sensorali primari.
Gli individui con neuropatia delle piccole fibre spesso però non riescono a sentire il dolore che si concentra in un’area molto piccola, come la puntura di uno spillo, e potrebbero non rendersi conto di essersi feriti. Tuttavia, hanno una maggiore sensibilità al dolore in generale (iperalgesia) e provano dolore da stimolazioni che tipicamente non causano dolore (ipoestesia). Le persone affette da questa condizione possono anche avere una ridotta capacità di differenziare tra caldo e freddo. Tuttavia, in alcuni individui, gli attacchi di dolore sono innescati proprio dal caldo o dal freddo. (Fonte: https://ghr.nlm.nih.gov/condition/small-fiber-neuropathy)
I sintomi di solito peggiorano di notte e spesso influenzano il sonno. Alcuni pazienti dicono che i loro piedi sono diventati così sensibili e doloranti da non poter sopportare il tocco delle lenzuola e così dormono con i piedi scoperti. Un piccolo numero di pazienti non ha dolore, ma riferisce una sensazione di oppressione e gonfiore ai piedi (anche se i piedi sembrano normali). (15)
Il coinvolgimento primario del Sistema Nervoso Autonomo significa che le piccole fibre con funzioni autonomiche sono prevalentemente compromesse, piuttosto che le piccole fibre con funzioni somatiche. (4)
Nelle tipiche forme di Neuropatia delle Piccole Fibre dolorosa, i pazienti possono segnalare sintomi autonomici; in questo caso, la disfunzione delle fibre colinergiche e vasomotorie della pelle si verifica più frequentemente rispetto a un coinvolgimento sistemico adrenergico, che spiega l’osservazione che la disregolazione vascolare della pelle negli arti inferiori si verifica più frequentemente rispetto alla disautonomia cardiovascolare sistemica. (4)
La Polineuropatia delle Piccole Fibre è un substrato biologico plausibile per il Dolore Cronico Diffuso (Chronic Widespread Pain, CWP). Di solito inizia negli assoni più lunghi, causando dolore distale o in prevalenza distale. Alcuni pazienti sviluppano sintomi a chiazze o prevalentemente prossimali, attribuiti all’attacco prossimale sui corpi cellulari neuronali (ganglionopatia/neuronopatia).(12) Poiché le piccole fibre innervano densamente e regolano anche il tono dei microvasi, è comune un aspetto anomalo nelle aree interessate (ad es. edemi, cambiamenti di colore).(6,7,13)
Le piccole fibre erano precedentemente dicotomizzate come somatiche rispetto a quelle autonomiche, una distinzione offuscata dalle recenti scoperte che svelano che gli assoni somatici/nocicettivi hanno effetti efferenti e trofici precedentemente considerati autonomici,(14) e che gli assoni, innervando le ghiandole sudoripare e i vasi sanguigni, esprimono il recettore del dolore TRPV1/capsaicina. (3,7,16)
La SFPN è una causa comune di disautonomia (7); è una malattia spesso non diagnosticata e disabilitante. I sintomi autonomici sono caratteristici delle sindromi dolorose croniche mediate dalle piccole fibre, dal momento che il termine “piccola fibra” comprende sia gli assoni simpatici che nocicettivi all’interno dei nervi periferici.
Sintomi SOMATICI o SENSORIALI
Possono includere:
- ridotta percezione sensoriale (ad esempio, del dolore),
- dolore
- prurito,
- bruciore,
- dolore lancinante,
- formicolio,
- intorpidimento,
- sensazioni di punture d’ago, di spillo
- debolezza muscolare (17),
- crampi,
- sensibilità cutanea
- e altri sintomi.
Le persone affette descrivono il dolore in diversi altri modi: una lama o un ago conficcato nell’osso o nella carne, una scossa elettrica, camminare su vetri rotti o persino su carboni ardenti. In alcuni casi si può verificare una perdita nella capacità di sentire dolore urtando contro un oggetto, procurandosi inavvertitamente delle “ferite” talvolta importanti.
Sintomi AUTONOMICI o VEGETATIVI (3,7,17-20)
Possono altresì manifestarsi, e possono includere:
- sintomi cardiovascolari (19), ad es, POTS (Sindrome da Tachicardia Ortostatica Posturale, svenimenti, che possono a loro volta determinare sintomi di vertigini, stanchezza cronica (17), nebbia mentale, disfunzioni cognitive (20), mal di testa cronico, più in generale disregolazione e disautonomia,
- aumento o diminuzione della perfusione che si manifesta come cambiamento del colore della pelle o della temperatura,
- aumento o diminuzione della sudorazione termoregolatoria (disturbi della sudorazione, scarsa o eccessiva), che si manifesta come cambiamento del colore della pelle o della temperatura corporea,
- incapacità di percepire il calore e/o il freddo,
- disfunzione sessuale,
- dismotilità gastrointestinale con sintomi gastrointestinali quali diarrea, costipazione (anche molto severa, fino a pseudo-ostruzioni), sindrome del colon irritabile, nausea, vomito,
- secchezza oculare e della bocca,
- alterazione dei riflessi pupillari con sensibilità alla luce intensa,
- disturbi urinari (incontinenza, difficoltà di svuotamento completo della vescica, altre disfunzioni urinarie),
- e altri sintomi.
SINTOMI IN ETA’ PEDIATRICA E ADOLESCENZA: (3)
Recenti Studi (2013) hanno rilevato che la Neuropatia delle Piccole Fibre può manifestarsi anche in bambini e adolescenti. Questa parte è riportata più avanti nell’ambito delle “Scoperte più Recenti”, Neuropatia delle Piccole Fibre ad esordio precoce (early onset Small Fiber Neuropathy, eoSFN), della quale di seguito sono riassunti i sintomi principali:
- Esordio del dolore nelle mani e nei piedi
- Sintomi Cardiovascolari (POTS, Tachicardia)
- Sintomi Gastrointestinali (mal di pancia, vomito, stipsi, incontinenza, nausea)
- Sudorazione alterata
- Sintomi urologici
- Severo mal di testa cronico
L’età media all’esordio dei sintomi era di 12,3 ± 5,7 anni; l’età alla presentazione era in media di 20,8 ± 9,1 anni.
ALTRE FORME E SINTOMI BAMBINI E ADULTI: (3)
- Alcuni casi possono manifestarsi in modo improvviso come un episodio acuto isolato (come la Guillain Barrè)
- Molti casi cronici sono stati associati alla CIDP (Chronic Inflammatory Demyelinating Polyneuropathy, Polineuropatia Infiammatoria Cronica Demielinizzante)
- Un caso di SFN recidivante-remittente responsiva agli steroidi
- Esistono poi alcune forme pre-cancerose delle cellule immunitarie (MGUS, Monoclonal Gammopathy of Undetermined Significance, Gammopatia Monoclonale di Significato Indeterminato)
- Alcuni casi colpiscono solo il braccio (plessite brachiale)
DIAGNOSI: (2,3,4)
La SFPN è difficile da diagnosticare poiché gli esami motori e dei riflessi rimangono normali e i test standard di conduzione nervosa ed elettromiografia non sono sensibili e non la rilevano. La biopsia cutanea neurodiagnostica dalla gamba distale è l’unico test diagnostico obiettivo per la SFPN raccomandato dall’American Academy of Neurology e dalla European Federation of Neurological Societies. (21)
Gli esami neurologici possono non mostrare Neuropatia delle Piccole Fibre:
- Nessuna debolezza o atrofia muscolare come in altri tipi di neuropatia
- I riflessi generalmente rimangono nella normalità
- Le sensazione date dalle “grandi fibre” (vibrazione, tatto), solitamente rimangono inalterate
- Le funzioni delle “piccole fibre” (percezione della puntura di spillo, del calore, la sudorazione) possono essere non del tutto perse nei casi “lievi” o in “fase iniziale”
Gli esami diagnostici abitualmente utilizzati per una neuropatia (Elettromiografia e Studi di conduzione del nervo) non rilevano la Neuropatia delle Piccole Fibre:
- L’Elettromiografia (EMG) analizza solo gli assoni diretti ai grandi muscoli
- Lo Studio di Conduzione del Nervo (ENG) studia solo i grandi assoni mielinizzati
- La biopsia chirurgica del nervo era il “gold standard” ma è invasiva, costosa, e può lasciare dolore e intorpidimento della parte operata. Non può essere ripetuta per monitorare la progressione della malattia o la risposta a un trattamento
La diagnosi di Neuropatia delle Piccole Fibre si basa sui sintomi e sull’esame diagnostico “gold standard” da Linee Guida Internazionali del 2010 che è la biopsia cutanea per lo studio dell’innervazione intraepidermica. (22)
Questo esame istologico (su un campione di cute di circa 3 mm, in anestesia locale ed indolore) misura la Densità delle Fibre Nervose Intra-Epidermiche (IntraEpidermic Nerve Fiber Density, IENFD) e può essere eseguito con 2 metodi di analisi:
- Immunoistochimico a campo luminoso (Bright Field Immunistochemistry, BFI)
- Immunofluorescenza Indiretta (Immunofluorescence)
I valori di riferimento per i risultati della biopsia cutanea sono confermati dal 2010 per il metodo Immunoistochimico a campo luminoso (Bright Field Immunistochemistry, BFI) (22)
Il metodo a Immunofluorescenza Indiretta (23) è stato utilizzato nell’ambito di uno studio basato sui dati di 4 laboratori (2 USA, 2 Europa, in Italia) coinvolgente più di 500 soggetti sani, al fine di regolamentare in modo attendibile, uniforme e riconosciuto, i valori di riferimento “internazionali” anche per questo metodo, stratificandoli per fascia di età (ogni decade, confermando una fisiologica riduzione delle fibre con l’aumentare dell’età) e per genere (maschile e femminile, registrando una differenza fisiologica di una fibra in più per il genere femminile).
La stessa stratificazione era già stata stabilita per il metodo Immunoistochimico a campo luminoso, il quale presenta range con valori più bassi per la minore capacità di visione delle piccole fibre.
I due metodi di analisi istologica della biopsia cutanea (a Immunofluorescenza Indiretta e Immunoistochimico a Campo Luminoso) sono stati messi a confronto e dichiarati a validità “comparabile”, pur con un’evidenza della maggiore capacità di visualizzazione delle piccole fibre con il metodo a Immunofluorescenza Indiretta.(24)
Questo implica che quest’ultimo consente di visualizzare un maggior numero di fibre in tutti i soggetti esaminati, determinando valori di riferimento più elevati rispetto al metodo Immunoistochimico a campo luminoso. Esistono anche valori di riferimento a parte per Bambini e Adolescenti. (3)
Per approfondimenti:
- Biopsia Cutanea: Linee Guida Europee sull’uso nella diagnosi di Neuropatia delle Piccole Fibre. Anno 2010
- Neuropatia-delle-Piccole-Fibre: è Scienza, firmata “Italia”, con tanti illustri contributi.
- Biopsia Cutanea Neurodiagnostica: Centri Ospedalieri in Italia, Metodi, Marcatori, Valori di Riferimento Diagnostici.
Altri esami necessari per la diagnosi e il trattamento della Neuropatia delle Piccole Fibre sono i Test della Funzionalità Autonomica (1):
- Sudorazione, Termoregolazione: QSART, Test Quantitativo del Riflesso Assonale Sudomotorio; Studio della sudorazione mediante test di Minor, Studio quantitativo dinamico della sudorazione
- Soglie tattili, termiche dolorifiche: Studio quantitativo
- Cardiovascolare: Tilt Test con studio neurovegetativo (inclusa Manovra di Valsalva) secondo linee guida internazionali (per POTS, Sindrome da Tachicardia Ortostatica Posturale, ad esempio: aumento della Frequenza Cardiaca di 30 battiti per minuto, tra la posizione supina ed la posizione eretta, indipendentemente dalla Pressione Arteriosa, tenendo conto anche della componente fisiologica di aumento della pressione arteriosa che può verificarsi per l’agitazione dell’esame stesso – eventuale utilizzo di vasodilatatore che simuli il caldo – in alternativa, ipotensione ortostatica, o sbalzi di pressione di origine oscura)
- Gastrointestinali: per il colon – Studio dei Tempi di Transito Intestinali RX con marcatori radiopachi; – per lo svuotamento gastrico: scintigrafia dello svuotamento gastrico – per il tenue: ecografia SICUS. In casi particolarmente gravi: manometrie (ad esempio rettoanale) o del tratto GI completo (in regime di ricovero)
- Urinari: esame urodinamico
- Riflessi pupillari: misurazione delle alterazioni dei riflessi pupillari di dilatazione e costrizione in risposta alla luce (con strumenti pupillometrici, talvolta osservabile da neurologo esperto durante la visita)
DISAUTONOMIA: (7,25)
Screening Surrogato/Complementare Diagnostico: (7) il Questionario “Scala COMPASS-31”
Il Test della Funzionalità Autonomica (Autonomic Function Test, AFT), costituisce il “gold standard” per la valutazione oggettiva della componente autonomica, ma richiede costose attrezzature non portatili, addestramento dell’operatore e preparazione per i pazienti. È disponibile solo in determinati centri universitari, pertanto i Questionari basati sui sintomi sono surrogati importanti, tra i quali per la SFPN è stato validato nella Letteratura Scientifica Internazionale la Scala COMPASS-31. In Italia è stato validato per la Neuropatia Diabetica.(25)
L’ipotesi dello studio del 2015 è che la SFPN sia la causa alla base della disautonomia, tuttavia, non esclude a priori cause centrali concomitanti, come i disturbi neurodegenerativi. Fortunatamente questi sono estremamente rari nelle coorti di pazienti di questa età. Il punteggio totale COMPASS-31 ha distinto significativamente i partecipanti con e senza SFPN, suggerendo una potenziale utilità diagnostica.
I risultati dello studio del 2015 rivelano un’eccellente validità interna e affidabilità test-retest, con una validità convergente medio-forte rispetto all’AFT (Autonomic Function Test, Test della Funzionalità Autonomica). Punti di forza di questo studio includono l’uso di comparatori multipli. Le forti correlazioni tra COMPASS-31 (che non include domande correlate al dolore) e Questionari che valutano il Dolore e la Qualità della Vita correlata alla Salute, supportano l’uso di COMPASS-31 nella valutazione della SFPN sia in ambito di Ricerca che Clinico.
COMPASS-31 quantifica 6 aree relative alle funzioni autonomiche:
- intolleranza ortostatica,
- vasomotoria,
- secretomotoria,
- gastrointestinale,
- vescicale
- pupillomotoria
Cenni storici alla Scala COMPASS-31: Nel 1999, il Prof. Phillip Low e colleghi della Mayo Clinic hanno sviluppato il questionario del Profilo dei Sintomi Autonomici (Autonomic Symptom Profile, ASP) di 169 elementi. Per migliorare l’utilità clinica, 85 domande di questo questionario (ASP) sono state attentamente selezionate per produrre il Punteggio Composito dei Sintomi Autonomici (COMPosite Autonomic Symptom Score, COMPASS). Sebbene migliorato, anche COMPASS non è stato ampiamente adottato; richiede tempo ai pazienti e ha un sistema di punteggio complesso che richiede addestramento. Per aumentare ulteriormente l’applicabilità, Singer e Mayo Clinic hanno ulteriormente perfezionato COMPASS in un questionario di 31 domande, con un punteggio semplice, denominato COMPASS-31. Nel 2012 Sletten et al. hanno pubblicato COMPASS-31. Lo studio del 2015 ha valutato COMPASS-31 in merito a: proprietà psicometriche, validità interna, affidabilità, validità costruttiva, capacità di distinguere tra i partecipanti diagnosticati con o senza SFPN come confermato dalle biopsie, e lo ha convalidato in una coorte di pazienti e soggetti di Ricerca, con una vasta gamma di sintomi autonomici.
I limiti dello studio includono: un numero relativamente piccolo di partecipanti per l’analisi ROC (Receiver Operating Characteristic, Caratteristiche Operative del Ricevente). Studi più ampi definirebbero con maggiore precisione l’accuratezza diagnostica di COMPASS-31 nel contesto della SFPN.
COMPASS-31 ha buone proprietà psicometriche nella popolazione di pazienti sottoposti a valutazione per SFPN e quindi potrebbe essere utile come strumento di screening iniziale per la SFPN rispetto ai più costosi test oggettivi.
Ad ulteriore sostegno dell’applicabilità, validità ed utilità di questo Strumento, anche uno Studio italiano, ma solo per la Neuropatia Diabetica.
Per approfondimenti:
- POTS, NPF e DISAUTONOMIA | Sindrome da Tachicardia Ortostatica Posturale
- POTS SINDROME in NPF, Descritta dal Malato
- Disautonomia e NPF: può definirsi Neuropatia Autonomica?
- Disautonomia Neuropatia Piccole Fibre Questionario COMPASS-31
- NPF: CIPO forme e cause. Proviamo a capire.
- NPF: esiste una correlazione con la CIPO? Di cosa si tratta?
- NPF e Parkinson. Focus sui sintomi autonomici. Connessione con malattie mitocondriali?
CRITERI DIAGNOSTICI: (3,4,26,27)
I criteri diagnostici rivisti (2010) si fondano su una classificazione basata su sintomi, segni e risultati di un esame validato.
- Diagnosi di SFN “possibile”: in caso di sintomi dipendenti dalla lunghezza e/o segni clinici di danni alle piccole fibre.
- Diagnosi di SFN “probabile”: in caso di sintomi dipendenti da lunghezza, segni clinici di danno alle piccole fibre e studi di conduzione del nervo surale con esiti nella norma.
- Diagnosi di SFN “certa”: in caso di sintomi lunghezza-dipendenti, segni clinici di danno delle piccole fibre, studi di conduzione del nervo surale nella norma, alterazione della densità delle fibre nervose intraepidermiche (IntraEpidermal Nerve Fiber, IENF) (mediante la biopsia cutanea) alla caviglia e/o Test Sensoriale Quantitativo (Quantitative Sensory Test, QST) e test delle soglie termiche al piede con risultati alterati.
Questi criteri sono stati proposti per la NPF da diabete, ma possono essere applicati a tutti i pazienti con sospetta SFN, indipendentemente dalla malattia o dalla condizione associata.
Per approfondimenti:
- Neuropatia-delle-Piccole-Fibre: è Scienza, firmata “Italia”, con tanti illustri contributi.
- “IN EVIDENZA” Neuropatia delle Piccole Fibre Bambini e Adolescenti Dolore e Disautonomia | Prove Scientifiche sin dal 2013
TRATTAMENTO:
Farmaci sintomatici per il dolore e per convivere con la disautonomia. Per trattare la Neuropatia delle Piccole Fibre è necessario scoprire la malattia primaria che la provoca e trattarla, laddove sia una malattia trattabile.
Sarà utile inoltre seguire gli sviluppi della Ricerca scientifica in merito alle possibili cause differenti e diversi trattamenti per fenotipo clinico (vedere più avanti, “Scoperte più Recenti”).
Per approfondimenti:
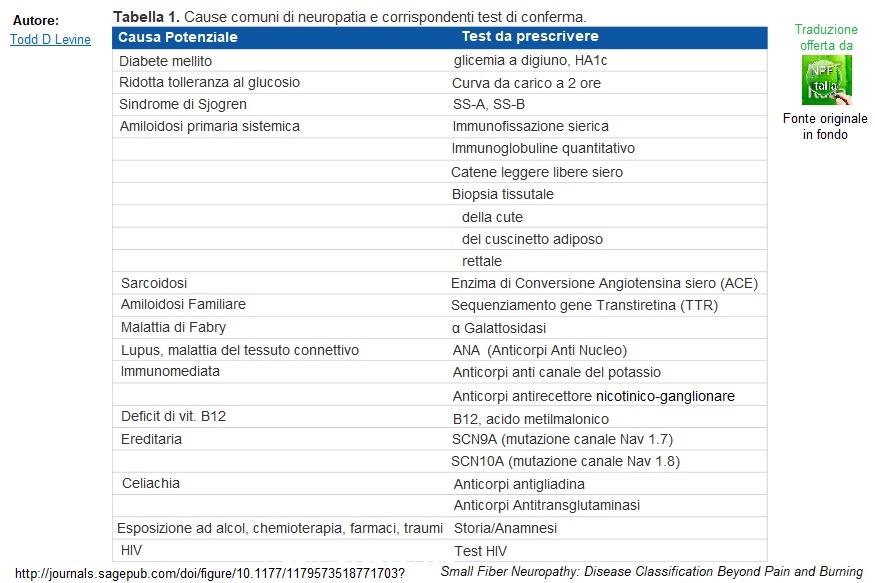
CAUSE:(1-4, 28-44)
Le cause sono disponibili nella Letteratura Scientifica Internazionale, qui riassunte nelle seguenti Tabelle
Tra le cause sono menzionate il diabete, l’alterata tolleranza al glucosio, le malattie del tessuto connettivo, ma anche una rapida correzione glicemica nel diabete mellito (condizione che viene indicata come un tempo conosciuta come “neurite insulinica”). Tra le cause genetiche la Malattia di Fabry, l’Amiloidosi Familiare, la Ehler Danlos Syndrome (EDS) (36) e le Canalopatie del Sodio.(40-44) È stata individuata una correlazione tra specifiche mutazioni nei geni che codificano questi canali e sintomi dolorosi ed autonomici, nonché una nuova mutazione in COL6A5 (38). Di recente scoperta una correlazione anche con un’altra malattia genetica rara, la Malattia di Wilson (39). Inoltre, correlazioni con la Charcot Marie Tooth, il Parkison e la SLA. Altre cause autoimmuni, metaboliche, deficit vitaminici, farmaci e tossine.
È fondamentale essere sottoposti agli esami ematici di laboratorio per scoprire la causa sottostante, potenzialmente trattabile.
Per approfondimenti:
- Cause Trattabili di Neuropatia delle Piccole Fibre
- Amiloidosi e NPF: Colorazione Rosso Congo nella Biopsia Cutanea
LE SCOPERTE SCIENTIFICHE PIU RECENTI:
CANALOPATIE DEL SODIO: (40-44)
Già da alcuni anni in tutto il mondo sono nel mirino dei Ricercatori i geni delle cosiddette canalopatie del sodio. Alcune mutazioni patologiche in alcuni di questi geni (SCN9A, SCN10A, SCN11A), sono state riscontrate responsabili della componente dolorosa della Neuropatia delle Piccole Fibre. Il dolore in alcuni soggetti può però non essere derivante da queste mutazioni, né correlato a queste canalopatie, come è emerso nel 2018 con la pubblicazione di uno studio che suddivide diverse forme di SFN in base ai sintomi – anche dolorosi – differenti, di seguito riportato.
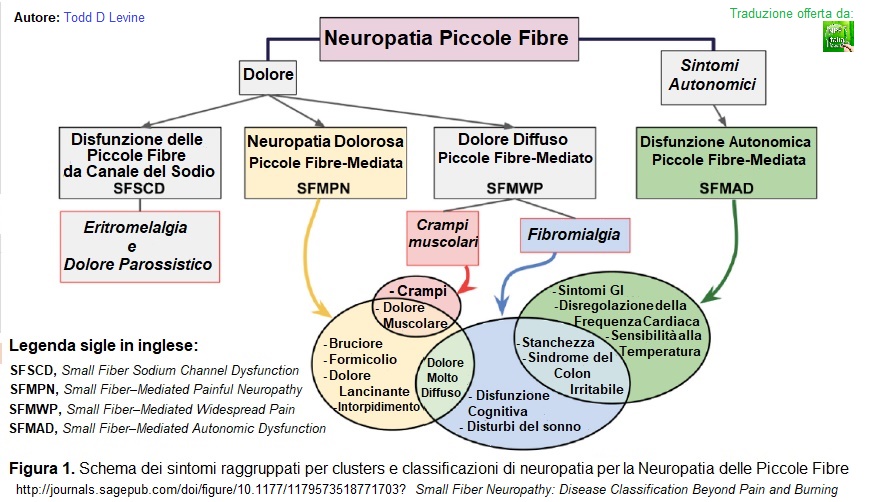
FENOTIPI CLINICI: (45)
Recenti studi, infatti, classificano la Neuropatia delle Piccole Fibre in 4 fenoticipi clinici sulla base dei sintomi predominanti:
- SFSCD (Small Fiber Sodium Channel Dysfunction, Disfunzione delle Piccole Fibre da Canale del Sodio), pazienti con disfunzione del canale del sodio (37)
- SFMPN (Small Fiber–Mediated Painful Neuropathy, Neuropatia Dolorosa Piccole Fibre-Mediata), pazienti con sintomi neurologici classici
- SFMWP (Small Fiber–Mediated Widespread Pain, Dolore Diffuso Piccole Fibre-Mediato), pazienti con dolore neuropatico diffuso
- SFMAD (Small Fiber–Mediated Autonomic Dysfunction, Disfunzione Autonomica Piccole Fibre-Mediata), pazienti con sintomi autonomici
È possibile una forma esclusivamente somatica – con solo dolore – una disfunzione puramente autonomica, o in alcuni pazienti una combinazione di entrambe. Può comportare sintomi classici di dolore neuropatico o sintomi dolorosi più diffusi e che coinvolgono anche la parte muscolare.
Essere in grado di classificare ed analizzare i pazienti nei diversi sottogruppi di neuropatie consente una migliore comprensione della fisiopatologia, diagnosi più precise e un potenziale miglioramento delle condizioni del paziente: terapie più mirate ed efficaci. Le terapie devono essere valutate in base al gruppo di appartenenza, per evitare trattamenti inutili o addirittura dannosi.
NEUROPATIA DELLE PICCOLE FIBRE A ESORDIO PRECOCE (3)
(early onset Small Fiber Neuropathy, eoSFN, Neuropatia delle Piccole Fibre ad esordio precoce)
Può manifestarsi in bambini e adolescenti. Prima di questa scoperta, la Letteratura Scientifica riteneva che i bambini non potessero essere colpiti da neuropatia (eccetto nel caso di alcune Malattie Rare, ad es. la HSAN) in quanto non hanno le cause sottostanti più comuni che possono invece provocarla nell’adulto (ad es. diabete, chemioterapia). Uno studio retrospettivo su 41 pazienti con esordio dei sintomi prima dei 21 anni di età, ha rilevato che la maggior parte era stata etichettata con diagnosi di “Fibromialgia Giovanile” ed ha rilevato – con il test diagnostico della biopsia cutanea e test della funzionalità autonomica – trattarsi di Neuropatia delle Piccole Fibre. È stata pertanto descritta un possibile “nuova malattia” mai osservata prima, definita Neuropatia delle Piccole Fibre ad esordio precoce (early onset Small Fiber Neuropathy, eoSFN) i cui sintomi principali sono riassunti sopra.
L’età alla comparsa della malattia è stata in media di 12,3 ± 5,7 anni; il 73% di questo campione polietnico era di genere femminile (P = 0,001). Il 68% era disabile cronico e il 68% era stato ricoverato in ospedale. Il test obiettivo ha diagnosticato “SFPN definita” nel 59%, “probabile” SFPN nel 17% e “possibile SFPN” nel 22%. Solo 1 su 41 aveva risultati di test per SFPN completamente normali. Il 98% dei pazienti presentava altri disturbi somatici compatibili con la disautonomia data dalla SFPN (90% cardiovascolare, 82% gastrointestinale e 34% urologica), l’83% ha riportato stanchezza cronica e il 63% presentava cefalea cronica. Gli esami neurologici hanno identificato sensazioni ridotte nel 68% e anomalie vasomotorie nel 55%, incluso il 23% con eritromelalgia. Ricerche esaustive per la causa della SFPN hanno identificato solamente una storia di malattie autoimmuni nel 33% dei casi e marcatori sierologici di disordini immunologici nell’89%. Il trattamento con corticosteroidi e/o immunoglobuline per via endovenosa ha portato beneficio obiettivo e soggettivo nell’80% dei pazienti (12/15). Più della metà di questa serie di pazienti con dolore cronico diffuso inspiegabile nell’infanzia, ha incontrato criteri diagnostici rigorosi, multitest, per SFPN, che estende la fascia di età della SFPN acquisita alla prima infanzia. Alcuni casi sono risultati immuno-mediati e sono migliorati con terapie immunomodulanti.
Questa serie di casi fornisce nuove ipotesi sulle sindromi di inspiegabile Dolore Cronico Diffuso ad insorgenza nell’infanzia, implicanti SFPN acquisita, una diagnosi biologicamente plausibile non precedentemente riconosciuta nei bambini.
Il riconoscimento della SFPN a esordio giovanile dovrebbe aiutare pazienti, famiglie e medici suggerendo un percorso razionale per la valutazione e il trattamento diagnostico. Avere una diagnosi specifica da testare e curare, quando presente, può ridurre test e trattamenti inefficaci, costosi e potenzialmente dannosi e consentire test oggettivi e il trattamento definitivo di alcuni pazienti.
La somministrazione cronica di farmaci per il dolore palliativo ha effetti avversi medici e sociali che sono ancora meno accettabili nei bambini che negli adulti.
Queste sindromi giovanili di Dolore Cronico Diffuso sempre più frequenti, spesso distruggono intere famiglie e interferiscono con l’educazione e lo sviluppo dei bambini
L’età media all’esordio dei sintomi era di 12,3 ± 5,7 anni; l’età alla presentazione era in media di 20,8 ± 9,1 anni. I dati suggeriscono che la SFPN può svilupparsi anche nei bambini in età prescolare e che la SFPN ad esordio giovanile può persistere per decenni nell’età adulta.
La SFPN di solito inizia negli assoni più lunghi, causando dolore distale (alle estremità, mani e piedi) o in prevalenza distale (nei piedi). Alcuni pazienti sviluppano sintomi a chiazze (persino sulle guance e orecchie) o prevalentemente prossimali, attribuiti all’attacco prossimale sui corpi cellulari neuronali (ganglionopatia/neuronopatia). Poiché le piccole fibre innervano densamente e regolano anche il tono dei microvasi, un aspetto anomalo (ad es. edemi, cambiamenti di colore) è comune nelle aree interessate. Sono stati identificati tutti i caratteristici pattern temporali (acuto/fulminante versus cronico) e spaziali (distale versus a chiazze/prossimale) delle polineuropatie.
Gli esami generali hanno identificato costantemente tachicardia sinusale e pressione arteriosa anomala, di solito ipotensione ortostatica. Diversi pazienti hanno documentato vesciche neurogene episodiche. Queste erano spesso sugli arti, anche nel cavo orale e sul viso. I pazienti occasionali avevano riflessi pupillari pigri.
Le sindromi di Dolore Cronico Diffuso spesso includono altri disturbi inspiegabili tra cui vertigini, stanchezza, mal di testa e nausea. Più della metà dei pazienti giovani con capogiri attribuiti alla Sindrome da Tachicardia Ortostatica Posturale (Postural Orthostatic Tachycardia Syndrome, POTS) aveva anche cefalea cronica, dolore addominale (inclusa grave stipsi) e/o stanchezza suggerendo una possibile eziologia comune. Con sintomi disautonomici onnipresenti, segni e anomalie dei test, la SFPN giovanile integra componenti del dolore sia autonomo che neuropatico. Inaspettatamente, il 63% dei pazienti soffriva di mal di testa cronico.
La maggior parte dei pazienti era malata moderatamente o gravemente, dimostrato dalle loro vaste indagini/valutazioni mediche presso i principali centri medici accademici. Il 68% era stato ricoverato in ospedale e il 68% aveva chiesto di lasciare la scuola o il lavoro. Non sono state identificate altre diagnosi patogenetiche che spiegassero il loro dolore diffuso (ad es., Artrite, miopatia). L’etichetta sindromica più comune all’ingresso nello studio era la fibromialgia; altri includevano disordine funzionale, sensibilizzazione centrale, sindrome da amplificazione del dolore, stanchezza cronica, sindrome del dolore miofasciale e malattia di Lyme cronica sieronegativa. Le etichette sindromiche specifiche per organo comprendevano POTS, intestino irritabile, dispepsia funzionale, emicrania addominale e cefalea cronica quotidiana. Quattro pazienti avevano anche sindrome dell’ovaio policistico e 3 avevano la sindrome di Ehlers-Danlos. Le diagnosi psichiatriche (somatizzazione, conversione) erano state spesso considerate, sebbene fosse stata documentata solo 1 malattia psichiatrica, in particolare la depressione maggiore attribuita al dolore incessante.
La diagnosi di SFPN è difficile perché i segni familiari di neuropatia delle grandi fibre sono assenti o minimi e il test elettrodiagnostico è insensibile. I test raccomandati per la diagnosi obiettiva di SFPN sono stati applicati qui: biopsia cutanea specificamente distale della gamba, immunomarcata per rivelare le fibre nervose epidermiche nocicettive (Epidermal Nerve-Fibers, ENF) (raccomandazione di livello C dell’American Academy of Neurology, raccomandazione di livello A della Federazione Europea delle Società di Neurologia), e test di funzionalità autonomica (Autonomic Function Testing, AFT). Questo consiste in 4 test validati della funzione cardiovagale, adrenergica e sudomotoria delle piccole fibre (raccomandazione di livello B dell’American Academy of Neurology). La biopsia cutanea neurodiagnostica, i test di funzionalità autonomica e la biopsia del nervo consentono una diagnosi obiettiva.
Per approfondimenti: “IN EVIDENZA” Neuropatia delle Piccole Fibre Bambini e Adolescenti Dolore e Disautonomia | Prove Scientifiche sin dal 2013
NEUROPATIA DELLE PICCOLE FIBRE IMMUNOMEDIATA (46)
(apparently autoimmune Small Fiber Neuropathy, aaSFN, Neuropatia delle Piccole Fibre apparentemente autoimmune):
Per approfondimenti: Casi di NPF (SFPN) Idiopatica in realtà Autoimmune e Trattabile. Nuova Scoperta. Da fonte Scientifica USA di livello Mondiale, per bambini, adolescenti, oltre che adulti
NEUROPATIA DELLE PICCOLE FIBRE IMMUNOMEDIATA DA AUTOANTICORPI ANTI TS‑HDS e FGFR-3 (47)
Recentemente sono stati portati all’attenzione due nuovi autoanticorpi, anti TS-HDS (contro un componente disaccaride della glicosilazione dell’eparina ed eparina solfato) e anti FGFR-3 (contro un recettore del secreto della superficie cellulare) diretti contro antigeni neuronali, che sembrerebbero avvalorare l’ipotesi di una sottostante causa autoimmune fino ad ora non associata alla Neuropatia delle Piccole Fibre. Rappresenterebbe una spiegazione scientifica per la risposta positiva al trattamento immunomodulante con IVIG in alcuni pazienti. La ricerca di questi marcatori infiammatori/autoimmuni potrebbe essere quindi molto utile per fare una diagnosi definitiva poiché, secondo questo studio retrospettivo su 117 pazienti con NPF dell’Università di Saint Louis, tra il 2014-2016, il 55% dei pazienti con Neuropatia delle Piccole Fibre è risultato positivo per il TS-HDS e il 23% per il FGFR3.
EHLER DANLOS SYNDROME E NEUROPATIA DELLE PICCOLE FIBRE: (36)
Per approfondimenti: Ehlers-Danlos Disease | la-Neuropatia-delle-Piccole-fibre-e-una-Caratteristica-Comune-delle-Sindromi-Ehlers-Danlos
FIBROMIALGIA: LA NEUROPATIA DELLE PICCOLE FIBRE CAUSA IL 50% DEI CASI DI FIBROMIALGIA: (5,6,48)
Per approfondimenti: Fibromialgia | Dalla Reumatologia USA: NPF e Fibromialgia. Due entità da distinguere. Come?
TRIAL CLINICI
Per appronfondimenti: TRIAL CLINICI IN EUROPA E NEL MONDO PER NPF/SFN/SFPN SONO REALTA’. FONTI DI INFORMAZIONE ISTITUZIONALI E 10 PUNTI PER UNA CONOSCENZA DI BASE.
LETTERATURA SCIENTIFICA MENO RECENTE: (1)
ANNO 2011: NPF: iniziamo a “familiarizzare” con la Neuropatia delle Piccole Fibre
RIFERIMENTI OSPEDALIERI PER DIAGNOSI DI NEUROPATIA DELLE PICCOLE FIBRE MEDIANTE BIOPSIA CUTANEA
Elenco stilato sulla base delle testimonianze dei Pazienti.*
Foto: Elenco Riferimenti per Biopsia Cutanea Neurodiagnostica in Italia
Per approfondimenti:
LINK DIRETTI SITI ISTITUZIONALI OSPEDALIERI:
Dove viene eseguita la Biopsia Cutanea Neurodiagnostica in Italia – alcuni siti web Ospedalieri Istituzionali:
Milano – Besta : http://www.istituto-besta.it/Area-Ricerca (vedere nel riquadro Contatti, Prenotazione ambulatori speciali- Biopsia Cutanea). Avviso: il sito del Besta è stato recentemente completamente rinnovato e il link qui riportato non conduce più alla pagina dedicata. Provvederemo a fornire il link corretto prima possibile.
Brescia – Spedali Civili : http://www.civile.asst-spedalicivili.it/servizi/unitaoperative/unitaoperative_fase02.aspx?ID=285 // Ambulatorio per lo Studio delle Malattie Neuromuscolari e delle Neuropatie
Bologna – Bellaria : https://www.ausl.bologna.it/isnb/ricerca/laboratori-di-ricerca/laboratorio-di-patologia-neuromuscolare, // https://www.ausl.bologna.it/isnb/chi-siamo/professionisti/i-nostri-professionisti/Vincenzo.Donadio
Benevento (Telese Terme) – Fondazione Salvatore Maugeri : http://www.fsm.it/uo-int.php?id=2978 (vedere paragrafo LABORATORIO PER LO STUDIO IMMUNOISTOCHIMICO DELL’INNERVAZIONE CUTANEA MEDIANTE PUNCH BIOPSY)
Note della Redazione, Ringraziamenti, Citazioni delle Fonti: Questo articolo – in ogni sua parte, inclusa traduzione – è puramente a scopo divulgativo e non è in alcun modo a scopo di lucro, ma pur sempre proprietà intellettuale degli anonimi Autori. Non sostituisce in alcun modo fonti mediche ufficiali, né il lavoro del medico. Rivolgersi sempre al proprio medico e fare sempre riferimento a testi e fonti originali. Non si risponde di alcun utilizzo improprio. Qualsiasi utilizzo a scopo di lucro non è autorizzato.
Per la diffusione di questo materiale si raccomanda la citazione della Fonte mediante pseudonimo dell’Autore in italiano neuropatiapiccolefibre con link alla Home di questo Blog https://neuropatiapiccolefibre.altervista.org o al presente articolo. Si raccomandano inoltre link alle Fonti originali in lingua inglese . Si tratta di un articolo ad accesso libero, che consente l’uso, la distribuzione e la riproduzione illimitati su qualsiasi supporto, a condizione che l’opera sia citata correttamente.
Per citare questo articolo: https://neuropatiapiccolefibre.altervista.org/neuropatia-delle-piccole-fibre-la-malattia-20-anni-di-letteratura-scientifica-internazionale/
Fonti Bibliografiche dalla Letteratura Scientifica Internazionale:
- Alexandra Hovaguimian, Christopher H. Gibbons, Diagnosis and Treatment of Pain in Small Fiber Neuropathy, Curr Pain Headache Rep. 2011 Jun; 15(3): 193–200.
- Terkelsen AJ, Karlsson P, Lauria G, Freeman R, Finnerup NB, Jensen TS. The Diagnostic Challenge of small fibre neuropathy: clinical presentations, evaluations, and causes – Lancet Neurol 2017; 16: 934-44
- Oaklander & Klein. Evidence of Small-Fiber Polyneuropathy in Unexplained, Juvenile Onset Widespread Pain Syndromes. Pediatrics 2013 Apr;131(4):e1091-100.
- Roberto Gasparotti, Luca Padua, Chiara Briani, Giuseppe Lauria. New technologies for the assessment of neuropathies. Nature Reviews Neurology volume 13, pages 203–216 (2017)
- Todd D. Levine, David S. Saperstein. Routine use of punch biopsy to diagnose small fiber neuropathy in fibromyalgia patients. Clin Rheumatol. 2015; 34(3): 413–417.
- Anne Louise Oaklander, MD, PhD, Zeva Daniela Herzog, BA, Heather Downs, BS, and Max M. Klein, PhD. Objective evidence that small-fiber polyneuropathy underlies some illnesses currently labeled as fibromyalgia. Pain. 2013 Nov; 154(11): 10.1016
- Treister R, O’Neil K, Downs HM, Oaklander AL. Validation of the composite autonomic symptom scale 31 (COMPASS-31) in patients with and without small fiber polyneuropathy. Eur J Neurol. 2015
- Oaklander, Neurotherapeutics 2015
- J. D. England et al. Practice Parameter: evaluation of distal symmetric polyneuropathy: role of autonomic testing, nerve biopsy, and skin biopsy (an evidence-based review). Report of the American Academy of Neurology, American Association of Neuromuscular and Electrodiagnostic Medicine, and American Academy of Physical Medicine and Rehabilitation. Neurology 72, 2009
- Albrecht et al, Pain Medicine, 2013
- Sukhomlinova I.E., Tichonovskay M.A., Yeryomina A.K., Voteva V.E., Rewiers Professor Belenichev I.F., Professor Kamyshniy A.M., MINISTRY OF HEALTH SERVICE OF UKRAINE, ZAPOROZHYE STATE MEDICAL UNIVERSITY – THE DEPARTMENT OF NORMAL PHYSIOLOGY, PHYSIOLOGY OF PAIN Methodical manual for students, 2015
- Gorson KC, Herrmann DN, Thiagarajan R, et al. Non-length dependent small fibre neuropathy/ganglionopathy. J Neurol Neurosurg Psychiatry. 2008;79(2):163–169
- Novak V, Freimer ML, Kissel JT, et al. Autonomic impairment in painful neuropathy. Neurology. 2001;56(7):861–868
- Holzer P. Efferent-like roles of afferent neurons in the gut: Blood flow regulation and tissue protection. Auton Neurosci. 2006;125(1-2):70–75
- Jinny Tavee, MD ; Lan Zhou, MD, PhD Small fiber neuropathy: A burning problem Cleveland Clinic Journal of Medicine. 2009 May;76(5):297-305
- Gibbons CH, Wang N, Freeman R. Capsaicin induces degeneration of cutaneous autonomic nerve fibers. Ann Neurol. 2010;68(6):888–898
- Dori, Lopate, Keeling, Pestronk, Myovascular innervation: axon loss in small fiber neuropathies, Muscle Nerve 2015
- J. D. England et al. Practice Parameter: evaluation of distal symmetric polyneuropathy: role of autonomic testing, nerve biopsy, and skin biopsy (an evidence-based review). Report of the American Academy of Neurology, American Association of Neuromuscular and Electrodiagnostic Medicine, and American Academy of Physical Medicine and Rehabilitation.Neurology 72, 2009
- Systrom, Faria, Waxman, Oaklander, Exercise limit in small fiber axonopathy, an invasive cardiopulmonary excercise test study, MDA Scientific Conference 2017
- Poda, Standind worsen cognitive functions in patients with neurogenic orthostatic hypotension, Neurological Science 2012
- G. Lauria, S. T. Hsieh, O. Johansson, W. R. Kennedy, J. M. Leger, S. I. Mellgren, M. Nolano, I. S. J. Merkies, M. Polydefkis, A. G. Smith, C. Sommer, J. Valls‐Solé. European Federation of Neurological Societies/Peripheral Nerve Society Guideline on the use of skin biopsy in the diagnosis of small fiber neuropathy. Report of a joint task force of the European Federation of Neurological Societies and the Peripheral Nerve Society. European Journal of Neurology 2010, 17: 903–912
- Lauria, G; Bakkers, M; Schmitz, C; Lombardi, R; Penza, P; Devigili, G; Smith, AG; Hsieh, ST; Mellgren, SI; Umapathi, T; Ziegler, D; Faber, CG; Merkies, IS (September 2010). Intraepidermal nerve fiber density at the distal leg: a worldwide normative reference study. Journal of the peripheral nervous system JPNS. 15 (3): 202–7.
- Provitera V, Gibbons CH, Wendelschafer-Crabb G, Donadio V, Vitale DF, Stancanelli A, Caporaso G, Liguori R, Wang N, Santoro L, Kennedy WR, Nolano M. A multi-center, multinational age- and gender-adjusted normative dataset for immunofluorescent intraepidermal nerve fiber density at the distal leg. European Journal of Neurology 2016, 23: 333–338
- Nolano M, Biasiotta A, Lombardi R, Provitera V, Stancanelli A, Caporaso G, Santoro L, Merkies IS, Truini A, Porretta-Serapiglia C, Cazzato D, Dacci P, Vitale DF, Lauria G. Epidermal innervation morphometry by immunofluorescence and bright-field microscopy. J Peripher Nerv Syst. 2015 Dec;20(4):387-91.
- 23. Greco C, Di Gennaro F, D’Amato C, Morganti R, Corradini D, Sun A, Longo S, Lauro D, Pierangeli G, Cortelli P, Spallone V. Validation of the Composite Autonomic Symptom Score 31 (COMPASS 31) for the assessment of symptoms of autonomic neuropathy in people with diabetes. Diabet Med. 2017 Jun;34(6):834-838. doi: 10.1111/dme.13310. Epub 2017 Jan 19.
- Tesfaye, S. et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments.Diabetes Care 33, 2285–2293 (2010).
- Malik, R. et al. Small fiber neuropathy: role in the diagnosis of diabetic sensorimotor polyneuropathy. Diabetes Metab. Res. Rev. 27, 678–684 (2011).
- Lang M, Treister R. Oaklander A.L. Diagnostic value of blood tests for occult causes of initially idiopathic small-fiber polyneuropathy. J Neurology 2016; 263:2515-2527.
- Farhad K, Traub R., Ruzhansky KM, Brannagan TH, 3rd. Causes of neuropathy in patients referred as “idiopathic neuropathy”. Muscle Nerve 2016; 53(6):856-61
- Gallagher G, Rabquer A, Kerber K, Calabek B, Callaghan B. Value of thyroid and rheumatologic studies in the evaluation of peripheral neuropathy. Neurology: Clinical Practice 2013; 3:90-8
- Peters MJ, Bakkers M, Merkies IS, Hoeijmakers JG, van Raak EP, Faber CG. Incidence and prevalence of neuropathy: A survey in the Netherlands. Neurology 2013; 81:1356-60
- Bedmarik J, Vckova-oravcva E, Bursova S, Belobradkova J, Dusck L, Sommer C. Etiology of small-fiber neuropathy. J Peripheral Nervous System 2009; 14:177-83
- England JD, Gronseth GS, Franklin G et al. Practice Parameter: Evaluation of distal symmetric polyneurpathy: role of laboratory and genetic testing. Neurology 2009 72:185-192
- de Sousa EA, Hays AP, et al. Characteristics of patients with sensory neuropathy diagnosed with abnormal small nerve fibres on skin biopsy. J Neurol Neurosurg Psychiatry 2006; 77:983-5
- Smith AG, Singleton JR. The diagnostic yieald of a standardized approach to idiopathic sensory –predominant neuropathy. Archives Internal Medicine 2004; 9:1021-1025
- Daniele Cazzato, MD, Marco Castori, MD, PhD, Raffaella Lombardi, PhD, Francesca Caravello, PhD, Eleonora Dalla Bella, MD, Antonio Petrucci, MD, Paola Grammatico, BSc, PhD, Chiara Dordoni, MD, Marina Colombi, PhD, and Giuseppe Lauria, MD. Small fiber neuropathy is a common feature of Ehlers-Danlos syndromesNeurology. 2016 Jul 12; 87(2): 155–159
- Andreas C Themistocleous, Juan D Ramirez, Jordi Serra, David L H Bennett, The clinical approach to small fibre neuropathy and painful channelopathy. Practical Neurology 2014;14:368-379.
- Martinelli-Boneschi, F. et al. Filippo Martinelli-Boneschi, Marina Colombi, Marco Castori, Grazia Devigili, Roberto Eleopra, Rayaz A. Malik, Marco Ritelli, Nicoletta Zoppi, Chiara Dordoni, Melissa Sorosina, Paola Grammatico, Hassan Fadavi, Monique M. Gerrits, Rowida Almomani, Catharina G. Faber, Ingemar S. J. Merkies, Daniela Toniolo, for the INGI Network, Massimiliano Cocca, Claudio Doglioni, Stephen G. Waxman, Sulayman D. Dib-Hajj, Michela M. Taiana, Jenny Sassone, Raffaella Lombardi, Daniele Cazzato, Andrea Zauli, Silvia Santoro, Margherita Marchi, Giuseppe Lauria. COL6A5 variants in familial neuropathic chronic itch.Brain, Volume 140, Issue 3, 1 March 2017, Pages 555–567
- Sturniolo GC, Lazzarini D, Bartolo O, Berton M, Leonardi A, Fregona IA, Parrozzani R, Midena E. Small fiber peripheral neuropathy in Wilson disease: an in vivo documentation by corneal confocal microscopy. Invest Ophthalmol Vis Sci. 2015 Jan 22;56(2):1390-5.
- Stephen G Waxman et al. Sodium Channel genes in pain-related disorders: phenotype-genotype associations and reccomendations for clinical use. Lancet Neurol 2014
- A.M. Habib et al. Sodium Channel and Pain. Handbook of Experimental Pharmacology 2015
- Xie W et al. Knockdown of sodium channel NaV1.6 blocks mechanical pain and abnormal bursting activity pf afferent neurons in inflamed sensory ganglia. Pain 2013
- Samad OA et al. Virus-mediatedd shRNA knockdown of NaV1.3 in rat dorsal root ganglion attenuates nerve injury-induced neuropathic pain. Mol Ther. 2013
- Fib-Hajj et al. Sodium channels in normal and pathological pain. Annu Rev Neurosci 2010.
- Todd D Levine, Small Fiber Neuropathy: Disease Classification Beyond Pain and Burning. J Cent Nerv Syst Dis. 2018; 10
- Liu X, Treister R, Lang M, Oaklander AL. IVIg for apparently autoimmune small-fiber polyneuropathy: first analysis of efficacy and safety. Ther Adv Neurol Disord. 2018 Jan 8;11:1756285617744484
- Reyanna Massaquoi, Jafar Kafaie, Atul Kumar, Pin-Win Chen, Ayesha Naeem. A comparison of different laboratory and clinical findings in Small fiber neuropathy (SFN) (P1.456). Neurology 2018; 90 (15 Supplement)
- Todd D. Levine, David S. Saperstein. Routine use of punch biopsy to diagnose small fiber neuropathy in fibromyalgia patients. Clin Rheumatol. 2015; 34(3): 413–417.